题目内容
19.海洋是巨大的宝库,下面是对海洋的开发利用两个工艺流程(一)如图是工业开发海水的某工艺流程.
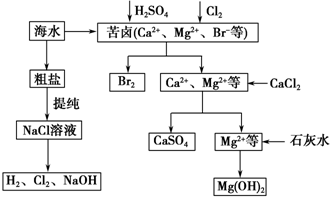
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是阳离子(Na+、H+);电解槽中的阳极材料为钛(或石墨).
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按 Br2、Mg(OH)2、CaSO4顺序制备?否;原因是如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯.
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重.
(二) 工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如图:
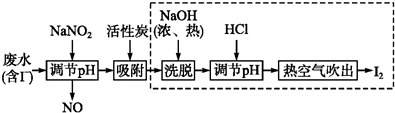
(4)向废水中加入NaNO2并调节pH<4,写出此反应的离子方程式:2NO2-+4H++2I-=2NO↑+I2+2H2O.
(5)写出该过程加入HCl调节pH发生的反应的离子方程式:H++OH-=H2O、IO3-+5I-+6H+=3I2+3H2O
(6)工业上虚线框内流程还可用如图操作代替,试评价图中替代流程 …→干燥→高温→I2的优点:减少化学药品的投入量,使成本大大降低(或生产环节减少、或药品对设备无腐蚀性等)(写出一条即可).
分析 (一)(1)电解饱和食盐水,阳极发生氧化反应,应用石墨为电解,阳极生成氯气,阴极生成氢气和氢氧化钠,则应用阳离子交换膜;
(2)苦卤中加入硫酸,如先加入石灰水,则可生成硫酸钙和氢氧化镁沉淀;
(3)如用四氯化碳萃取,然后还要进行蒸馏操作,操作复杂,且污染环境;
(二)(4)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮和碘和水;
(5)加入HCl调节pH发生的反应主要是和碱反应生成水,碘离子和碘酸根离子在酸性溶液中发生归中反应生成单质碘;
(6)对照工业上虚框内流程和图中操作,从原料、反应的简易、环保等角度进行分析;
解答 解:(一)(1)电解饱和食盐水,电解槽离子膜或隔膜,允许阳离子(或Na+)和水分子通过,不允许阴离子通过;阳极生成氯气,用石墨或钛做电极,
故答案为:阳离子(Na+、H+);钛(或石墨);
(2)工艺流程中先后制得Br2、CaSO4和Mg(OH)2,不能先生成沉淀Mg(OH)2,硫酸钙为微溶物,如果先生成沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,使产品不纯,
故答案为:否;如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯;
(3)因为溴单质在四氯化碳中的溶解度比在水中大得多,而且四氯化碳与水不互溶,因此可用于萃取,但也有缺点,如四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重,
故答案为:四氯化碳萃取法工艺复杂、设备投资大,经济效益低、环境污染严重;
(二) (4)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮和碘和水,离子反应方程式为:2NO2-+4H++2I-═2NO↑+I2+2H2O,
故答案为:2NO2-+4H++2I-=2NO↑+I2+2H2O;
(5)加入HCl调节pH发生的反应主要是和碱反应生成水,碘离子和碘酸根离子在酸性溶液中发生归中反应生成单质碘,反应的离子方程式为:H++OH-=H2O、IO3-+5I-+6H+=3I2+3H2O,
故答案为:H++OH-=H2O、IO3-+5I-+6H+=3I2+3H2O;
(6)工业上虚框内流程与图中操作流程比较,需氢氧化钠、盐酸对设备有一定的腐蚀性,化学药品的投入量大,需热能成本高,而图中操作流程仅需高温,减少了化学药品的投入量,使成本大大降低(或生产环节减少;或药品对设备无腐蚀性等),
故答案为:减少了化学药品的投入量,使成本大大降低(或生产环节减少;或药品对设备无腐蚀性等).
点评 本题考查较为综合,涉及海水的综合利用以及溶液的配制等知识,为高频考点,侧重于元素化合物知识的综合理解和运用的考查以及学生的分析能力、实验能力、计算能力的考查,注意把握海水的提取、冶炼原理,把握相关基础知识的积累和学习,难度中等.

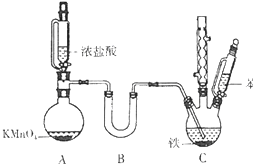 氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):
氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):可能用到的有关数据如下:
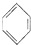 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$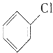 +HCl
+HCl| 沸点(℃) | 密度(g•mL-1) | 溶解性 | |
| 苯 | 80.1 | 0.88 | 难溶于水 |
| 氯苯 | 132.2 | 1.10 | 难溶于水,易溶于有机溶剂 |
| 对二氯苯 | 173.4 | 1.46 | 难溶于水,易溶于有机溶剂 |
| 邻二氯苯 | 180.4 | 1.30 | 难溶于水,易溶于有机溶剂 |
回答下列问题:
(1)A装置中制备氯气的离子方程式为2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O.
(2)B装置中盛放的药品为CaCl2或P2O5,C装置中采用的加热方法最好为40℃-60℃的水浴加热.
(3)已知浓盐酸和苯都具有较强的挥发性.采用如图所示装置加入液体的优点是防止液体挥发,能够平衡压强,使液体顺利流下.
(4)用氢氧化钠溶液洗涤可以除去杂质的化学式为HCl、Cl2、FeCl3,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净.
(5)该实验存在一定缺陷,改进措施为将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气.
(6)该实验所得氯苯的产率为44.4%(保留小数点后一位).
| A. | 标准状况下,46 g乙醇中含有的共价键总数为8 NA | |
| B. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
| A. | 1.0LpH=12的CH3COONa溶液中OH-一定为0.01NA | |
| B. | 常温下,20g2H2O含有的电子数为10NA | |
| C. | mgNa2O2与水反应产生1molO2时转移电子数为2NA | |
| D. | 标准状况下,22.4LN2和CO的混合物中含用电子对数目为2NA |
| A. | 可用热的纯碱溶液除去矿物油污渍 | |
| B. | 盐析可提蛋白质并保持其生理活性 | |
| C. | 单质硅不仅用于制造计算机芯片,也是生产太阳能电池的材料 | |
| D. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 |
 ;
;
 .
.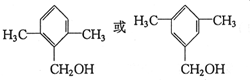 (任意填一种).
(任意填一种).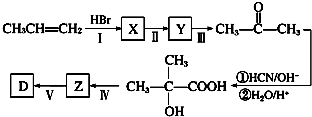
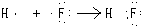 .
.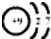 ,写出A、B两元素按1:1原子个数比形成化合物的电子式
,写出A、B两元素按1:1原子个数比形成化合物的电子式 .
.