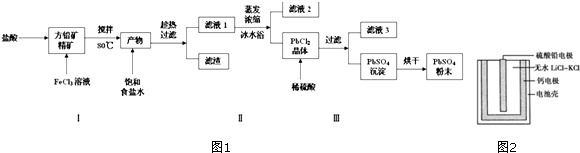
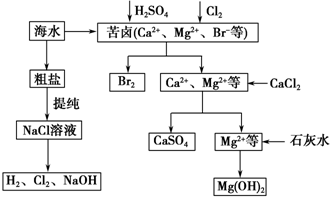
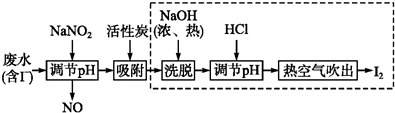
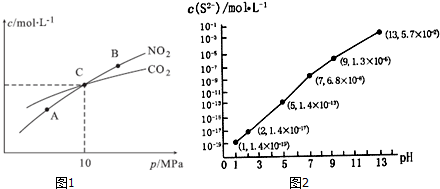
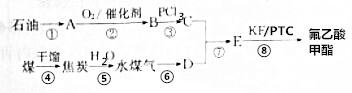
题目内容
14.有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线.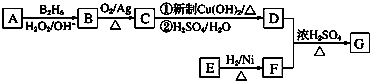
已知:①E能够发生银镜反应,1mol E能够与2mol H2完全反应生成F;
②R-CH═CH2$\underset{\stackrel{{B}_{2}{H}_{6}}{→}}{{H}_{2}{O}_{2}/O{H}^{-}}$R-CH2CH2OH;
③有机物D的摩尔质量为88g•mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链.
回答下列问题:
(1)用系统命名法命名有机物B:2-甲基-1-丙醇.
(2)E的结构简式为
 .
.(3)C与新制Cu(OH)2反应的化学方程式为(CH3)2CHCHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O.
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为在一支试管中取适量硝酸银溶液,边振荡边逐滴滴入氨水,当生成的白色沉淀恰好溶解为止.
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛.符合上述条件的有机物甲有13种.其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的有机物的结构简式为
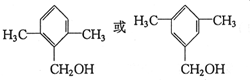 (任意填一种).
(任意填一种).(6)以丙烯等为原料合成D的路线如下:
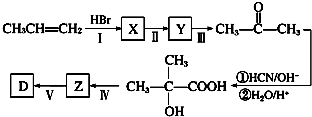
X的结构简式为CH3CHBrCCH3,步骤Ⅱ所需试剂及条件为氢氧化钠水溶液、加热,步骤Ⅳ的反应类型为消去反应.
分析 B连续氧化生成D为羧酸,F是苯甲醇的同系物,二者发生酯化反应是G,由G的分子式可知,D为一元羧酸,有机物D的摩尔质量为88g•mol-1,去掉1个-COOH剩余原子总相对原子质量为88-45=43,则$\frac{43}{12}$=3…6,故D的分子式为C4H8O2,F分子式为C9H12O.D的核磁共振氢谱显示只有3组峰,则D为(CH3)2CHCOOH,逆推可知C为(CH3)2CHCHO,B为(CH3)2CHCH2OH,结合信息可知A为(CH3)2C=CH2.有机物E能够发生银镜反应,且1molE能够与2molH2完全反应生成F,且F环上只有一个无支链的侧链,则E的结构简式为 ,F为
,F为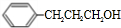 ,则G为
,则G为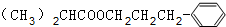 ,据此解答.
,据此解答.
解答 解:B连续氧化生成D为羧酸,F是苯甲醇的同系物,二者发生酯化反应是G,由G的分子式可知,D为一元羧酸,有机物D的摩尔质量为88g•mol-1,去掉1个-COOH剩余原子总相对原子质量为88-45=43,则$\frac{43}{12}$=3…6,故D的分子式为C4H8O2,F分子式为C9H12O.D的核磁共振氢谱显示只有3组峰,则D为(CH3)2CHCOOH,逆推可知C为(CH3)2CHCHO,B为(CH3)2CHCH2OH,结合信息可知A为(CH3)2C=CH2.有机物E能够发生银镜反应,且1molE能够与2molH2完全反应生成F,且F环上只有一个无支链的侧链,则E的结构简式为 ,F为
,F为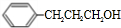 ,则G为
,则G为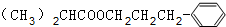 .
.
(1)B为(CH3)2CHCH2OH,用系统命名法命名为:2-甲基-1-丙醇,故答案为:2-甲基-1-丙醇;
(2)E的结构简式为: ,故答案为:
,故答案为: ;
;
(3)C与新制Cu(OH)2反应的化学方程式为:(CH3)2CHCHO+2Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$$\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O,
故答案为:(CH3)2CHCHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O;
(4)配制银氨溶液的实验操作为:在一支试管中取适量硝酸银溶液,边振荡边逐滴滴入氨水,当生成的白色沉淀恰好溶解为止,
故答案为:在一支试管中取适量硝酸银溶液,边振荡边逐滴滴入氨水,当生成的白色沉淀恰好溶解为止;
(5)有机物甲符合下列条件:①为芳香族化合物,说明含有苯环,②与F互为同分异构体;③能被催化氧化成醛,含有-CH2OH,含有1个取代基为-CH(CH3)CH2OH,含有2个取代基为-CH2CH3、-CH2OH,或者-CH3、-CH2CH2OH,各有邻、间、对3种,含有3个取代基为-CH2OH、2个-CH3,2个-CH3处于邻位时,-CH2OH有2种位置,2个-CH3处于间位时,-CH2OH有3种位置,2个-CH3处于对位时,-CH2OH有1种位置,故甲的结构共有13种,其中满足苯环上只有3个侧链,有核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的有机物的结构简式为  ,
,
故答案为:13; ;
;
(6)由转化丙酮结构可知,丙烯与HBr发生加成反应生成X为CH3CHBrCCH3,X在氢氧化钠水溶液、加热条件下发生水解反应生成Y为CH3CH(OH)CCH3,Y发生催化氧化生成丙酮,丙酮与HCN发生加成反应,再酸化得到 ,然后在浓硫酸、加热条件下发生消去反应生成Z为CH2=C(CH3)COOH,最后与氢气发生加成反应得到(CH3)2CHCOOH,
,然后在浓硫酸、加热条件下发生消去反应生成Z为CH2=C(CH3)COOH,最后与氢气发生加成反应得到(CH3)2CHCOOH,
故答案为:CH3CHBrCCH3;氢氧化钠水溶液、加热;消去反应.
点评 本题考查有机物的推断与合成,注意充分利用有机物的结构特点、分子式与反应条件进行推断,熟练掌握官能团的性质与转化,侧重考查学生分析推理能力,题目难度中等.

| A. | 元素X的简单气态氢化物的热稳定性比W的强 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | 元素Y、Z的单质都有金属光泽 | |
| D. | X分别与Y、Z、W形成的化合物所含化学键类型相同 |
 ,则M的结构式种类为( )
,则M的结构式种类为( )| A. | 16 | B. | 12 | C. | 10 | D. | 8 |
| A. | 能大量存在:Na+、C6H5O-、Cl-、Br- | |
| B. | 同温下通入少量的氨气:NH4+的水解能力增强,Kw增大,有白色沉淀产生 | |
| C. | 加入Ba(OH)2溶液生成沉淀质量最多的离子方程式:NH4++Al3++2Ba2++5OH-+2SO42-=2BaSO4↓+AlO2-+NH3•H2O+2H2O | |
| D. | 其浓溶液可与NaHCO3溶液混合制成灭火器 |