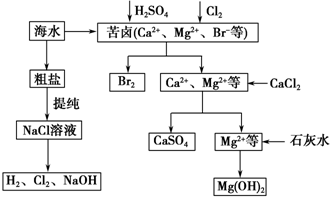
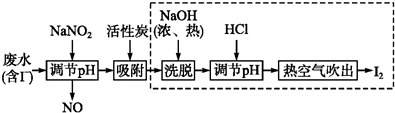
题目内容
9.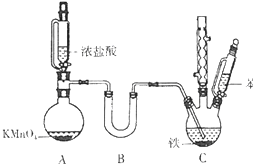 氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):
氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):可能用到的有关数据如下:
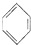 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$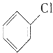 +HCl
+HCl| 沸点(℃) | 密度(g•mL-1) | 溶解性 | |
| 苯 | 80.1 | 0.88 | 难溶于水 |
| 氯苯 | 132.2 | 1.10 | 难溶于水,易溶于有机溶剂 |
| 对二氯苯 | 173.4 | 1.46 | 难溶于水,易溶于有机溶剂 |
| 邻二氯苯 | 180.4 | 1.30 | 难溶于水,易溶于有机溶剂 |
回答下列问题:
(1)A装置中制备氯气的离子方程式为2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O.
(2)B装置中盛放的药品为CaCl2或P2O5,C装置中采用的加热方法最好为40℃-60℃的水浴加热.
(3)已知浓盐酸和苯都具有较强的挥发性.采用如图所示装置加入液体的优点是防止液体挥发,能够平衡压强,使液体顺利流下.
(4)用氢氧化钠溶液洗涤可以除去杂质的化学式为HCl、Cl2、FeCl3,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净.
(5)该实验存在一定缺陷,改进措施为将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气.
(6)该实验所得氯苯的产率为44.4%(保留小数点后一位).
分析 (1)用浓盐酸和KMnO4反应制备氯气,Mn元素的化合价降低,Cl元素的化合价升高,根据得失电子守恒和电荷守恒书写离子反应方程式;
(2)干燥氯气需选择酸性干燥剂,因存放干燥剂的装置为U形管,需选择固体干燥剂;把氯气干燥后通入装有39mL苯的反应器C中(内有铁屑作催化剂),维持反应温度在40~60℃,反应的温度条件低于100℃,可用水浴的方法进行加热;
(3)装置C为球形冷凝管,起冷凝回流作用,防止液体挥发,A装置能够平衡压强,使液体顺利流下;
(4)氯苯中含有溶解的氯气、氯化氢、以及起催化作用产生的氯化铁,以上物质都可以与氢氧化钠反应,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,通过检验氯离子的存在,判断是否洗净;
(5)冷凝管上端开口,逸出的HCl、Cl2污染空气,需用碱液吸收;
(6)根据苯的质量计算氯苯的理论产量,产量=(实际产量÷理论产量)×100%.
解答 解:(1)用浓盐酸和KMnO4反应制备氯气,MnO4-→Mn2+,Mn元素的化合价降低(+7→+2),2Cl-→Cl2,Cl元素的化合价升高(-1→0),最小公倍数为10,根据得失电子守恒和电荷守恒所以离子方程式为:2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O;
(2)B装置中盛放的药品为干燥氯气的试剂,因氯气为酸性气体,且存放干燥剂的装置为U形管,需选择固体干燥剂,可选择CaCl2或P2O5,把氯气干燥后通入装有39mL苯的反应器C中(内有铁屑作催化剂),维持反应温度在40~60℃,反应的温度条件低于水的沸点100℃,水浴加热能有效控制反应温度,且能保证受热装置受热均匀,所以可用水浴的方法进行加热,
故答案为:CaCl2或P2O5;40℃-60℃的水浴加热;
(3)装置C为球形冷凝管,苯与浓硝酸都以挥发,C起冷凝回流作用,提高原料利用率,A装置橡皮管起气压平衡管的作用,使漏斗里面的气压与烧瓶的始终相等,使液体顺利流下,
故答案为:防止液体挥发,能够平衡压强,使液体顺利流下;
(4)氯苯中含有溶解的氯气、氯化氢、以及起催化作用产生的氯化铁杂质,用氢氧化钠溶液洗涤,氯化氢和氢氧化钠发生中和反应,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,再用蒸馏水洗涤,分离出的产物干燥,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,通过检验氯离子的存在,操作为:取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净,
故答案为:取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净;
(5)冷凝管上端开口,逸出的HCl、Cl2污染空气,存在一定缺陷,改进措施用碱液吸收,具体改进措施为:将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气,
故答案为:将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气;
(6)苯的质量为39mL×0.88g•mL-1=34.32g,完全反应生成氯苯的理论产量为34.32g×$\frac{112.5}{78}$=49.5g,故氯苯的产率为:$\frac{实际产量}{理论产量}$=$\frac{22g}{49.5g}$×100%≈44.4%,
故答案为:44.4%.
点评 本题考查有机物制备实验方案,题目难度中等,涉及对装置、操作与原理的分析评价等知识,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.

| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.Ⅰ.一种制备SOCl2的常用方法是:SO3+SCl2=SOCl2+SO2,其模拟装置如图所示(夹持装置略去),各物质的部分性质如下:
| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
樱桃红色变为无色现象时,说明反应完成,停止滴加SO3.
(2)B中所盛药品是浓硫酸,装置C中药品及选择该药品的作用分别是氢氧化钠、吸收尾气.
(3)反应后将A中混合物进行蒸馏,收集到较纯净的产品,需控制蒸馏温度在C左右.
a.44.8℃b.59℃c.76℃
Ⅱ.Li-SOCl2电池是一种优质高效的电池,常放在心脏起搏器中,电池的总反应可表示为4Li+2SOCl2=4LiCl+S+SO2,回答下列问题:
(4)电池正极发生的电极反应为2SOCl2+4Li++4e-=4LiCl+S+SO2.
(5)该电池必须在惰性环境中组装,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(6)若含金属锂6.9g的电池质量为m g,平均电压为n V,则该电池的比能量为$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1(用含有m、n的代数式,系数用科学计数法表示,结果保留三个有效数字:比能量=$\frac{电池输出电能}{电池质量}$,1W•h=3.6×103J,法拉第常数F=96500c•mol-1).
| A. | 元素X的简单气态氢化物的热稳定性比W的强 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | 元素Y、Z的单质都有金属光泽 | |
| D. | X分别与Y、Z、W形成的化合物所含化学键类型相同 |
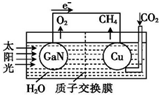 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )| A. | 该装置只有化学能转化为电能 | |
| B. | 氮化镓电极是阴极 | |
| C. | 导线中经过2mol的电子,氮化镓电极生成1molO2 | |
| D. | 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O |
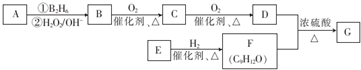
 ;该反应的反应类型为酯化反应或取代反应
;该反应的反应类型为酯化反应或取代反应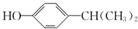
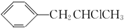 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):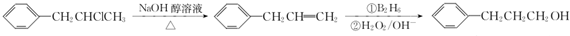 .
. .
.