题目内容
11.NA表示阿伏加德罗常数的值,下列说法中不正确的是( )| A. | 1.0LpH=12的CH3COONa溶液中OH-一定为0.01NA | |
| B. | 常温下,20g2H2O含有的电子数为10NA | |
| C. | mgNa2O2与水反应产生1molO2时转移电子数为2NA | |
| D. | 标准状况下,22.4LN2和CO的混合物中含用电子对数目为2NA |
分析 A.pH=12的1.0LCH3COONa溶液中水电离出的OH-的数目依据离子积常数计算分析判断;
B.n=$\frac{m}{M}$计算物质的量,水分子中含有10个电子计算判断;
C.Na2O2与H2O的反应2Na2O2+2H2O=4NaOH+O2↑,此反应转移2mol电子,生成1molO2;
D.n=$\frac{V}{22.4}$mol,氮气和一氧化碳分子结构中都含有三键结构.
解答 解:A.pH=12的1.0L CH3COONa溶液中,醋酸根离子水解,CH3COO-+H2O?CH3COOH+OH-,水电离出的OH-的数目依据离子积常数计算,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$=10-2mol/L,液中水电离出的OH-的数目=10-2mol/L×1L×NA=0.01NA,故A正确;
B.20g2H2O物质的量=$\frac{20g}{20g/mol}$=1mol,1个水分子中含有10个电子,所以含有的电子数为10NA,故B正确;
C.Na2O2与H2O的反应是歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应转移2mol电子,生成1molO2,故当生成1molO2,转移电子数目为2NA,故C正确;
D.标准状况下,22.4LN2和CO的混合物物质的量=$\frac{22.4L}{22.4L/mol}$=1mol,氮气和一氧化碳分子结构中都含有三键结构,分子中含用电子对数目为3NA,故D错误;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,注意过氧化钠中的氧元素化合价是-1价,要求学生掌握物质的量与气体摩尔体积、阿伏伽德罗常数、摩尔质量间的转化关系.掌握基础是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.M是苯的同系物,其结构为 ,则M的结构式种类为( )
,则M的结构式种类为( )
 ,则M的结构式种类为( )
,则M的结构式种类为( )| A. | 16 | B. | 12 | C. | 10 | D. | 8 |
16.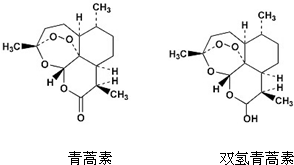 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )| A. | 两种有机物官能团的数目相同 | |
| B. | 两种有机物均可以发生取代反应 | |
| C. | 两种有机物均能和NaOH溶液反应 | |
| D. | 1mol双氢青蒿素与金属钠反应可以得到11.2L的氢气 |
16.某有机化合物结构简式如图,下列有关说法不正确的是( )
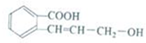

| A. | 该有机化合物分子式为C10H10O3 | |
| B. | 1mol该有机化合物最多可与2molNaOH发生中和反应 | |
| C. | 该有机化合物中两种官能团之间可以发生酯化反应 | |
| D. | 该有机化合物和乙烯均能使酸性高锰酸钾溶液褪色 |

 C.
C. D.
D.
 .
.