题目内容
7.铬铁矿主要用来生产铬铁合金和金属铬.称取0.0600g铬铁矿样品(主要成分是Cr2O3,杂质不参与反应),加入NaOH和Na2O2,高温熔融,反应完成后冷却至室温;加水溶解煮沸、过滤,向滤液中加入稍过量的H2SO4和KI溶液,摇匀;放于暗处一段时间后,取出立即用0.0100mol•L-1的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液15.00mL.已知:①Cr2O72-+I-+H+-Cr3++I2+H2O
②S2O32-+I2+H2O-SO4 2-+I-+H+(均未配平)
(1)Na2O2的作用是将铬从+3价氧化为+6价.
(2)取少量冷却后的固体加水溶解,再加MnO2会有大量气体产生.则上述过程中煮沸的目的是除去溶液中过氧化物.
(3)实验过程中溶液需置于暗处且取出后要立即滴定,否则会导致测定结果偏大.
(填“偏大”、“偏小”或“不变”)
(4)根据以上数据确定该铬铁矿样品中Cr2O3的质量分数.(写出计算过程)50.67%.
分析 (1)由滴定原理可知,Na2O2的作用是将铬从+3价氧化为+6价;
(2)过氧化氢有剩余,会将I-氧化为I2,影响测定结果;
(3)氧气会将I-氧化为I2,导致消耗Na2S2O3溶液体积偏大;
(4)根据电子转移守恒:4Cr2O72-~3S2O32-,结合Cr元素守恒:4Cr2O3~4Cr2O72-~3S2O32-,根据关系式计算.
解答 解:(1)由滴定原理:①Cr2O72-+I-+H+→Cr3++I2+H2O,②S2O32-+I2+H2O→SO4 2-+I-+H+(均未配平),可知Na2O2的作用是将铬从+3价氧化为+6价,
故答案为:将铬从+3价氧化为+6价;
(2)过氧化氢有剩余,会将I-氧化为I2,影响测定结果,则上述过程中煮沸的目的是:除去溶液中过氧化物,
故答案为:除去溶液中过氧化物,
(3)氧气会将I-氧化为I2,导致消耗Na2S2O3溶液体积偏大,会导致测定结果偏大,
故答案为:偏大;
(4)①中铬从+6价降低为+3价,②中S元素从+2升高为+6,根据电子转移守恒:4Cr2O72-~3S2O32-,结合Cr元素守恒:2Cr2O3~2Cr2O72-~3S2O32-,
设样品中Cr2O3的质量分数为w,则:
4Cr2O3~4Cr2O72-~3S2O32-
608g 3mol
0.0600g×w 0.0100mol•L-1×0.015L
所以608g:0.0600g×w=3mol:0.0100mol•L-1×0.015L
解得w=50.67%,
故答案为:50.67%.
点评 本题考查氧化还原反应反应滴定计算,关键是明确实验原理,掌握多步计算中利用关系式进行解答,是对学生综合能力的考查.

练习册系列答案
相关题目
18.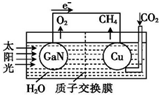 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )| A. | 该装置只有化学能转化为电能 | |
| B. | 氮化镓电极是阴极 | |
| C. | 导线中经过2mol的电子,氮化镓电极生成1molO2 | |
| D. | 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O |
2.M是苯的同系物,其结构为 ,则M的结构式种类为( )
,则M的结构式种类为( )
 ,则M的结构式种类为( )
,则M的结构式种类为( )| A. | 16 | B. | 12 | C. | 10 | D. | 8 |
12.研究证明,CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下:
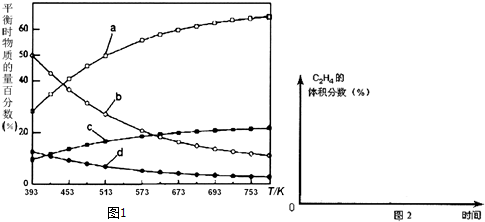
反应开始时在0.l MPa下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的物质的量百分数如图1所示,请回答下列问题:
(1)△H4=-128 kJ/mol.
(2)可判断该反应体系已平衡的是CE.
A.v (CO2)=2v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为H2(写化学式),判断依据是由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值.
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01kJ•mol-1 |
| 反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

(1)△H4=-128 kJ/mol.
(2)可判断该反应体系已平衡的是CE.
A.v (CO2)=2v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为H2(写化学式),判断依据是由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,反应开始时在0.1MPa下,n(H2):n(CO2)=3:1的投料比可知a为H2的变化曲线,c为CO2的变化曲线,结合计量数关系可知b为水,d为C2H4的变化曲线.
(4)为提高CO2的平衡转化率,可以采取的措施是ABD.
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值.
16.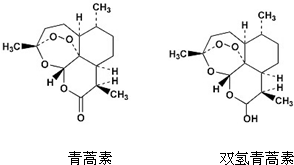 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )| A. | 两种有机物官能团的数目相同 | |
| B. | 两种有机物均可以发生取代反应 | |
| C. | 两种有机物均能和NaOH溶液反应 | |
| D. | 1mol双氢青蒿素与金属钠反应可以得到11.2L的氢气 |
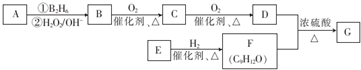
 ;该反应的反应类型为酯化反应或取代反应
;该反应的反应类型为酯化反应或取代反应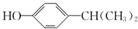
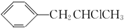 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):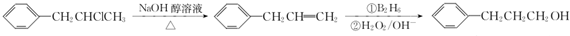 .
.
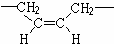 ,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.
,若顺丁橡胶的平均相对分子质量为540054,则平均聚合度为10001.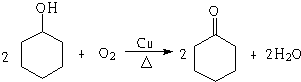 .
.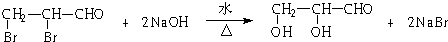 .
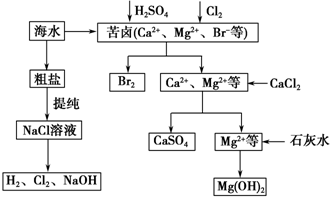
.
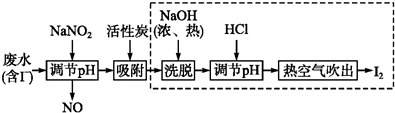
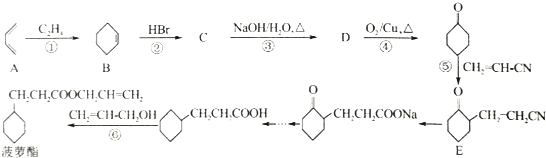
 )是临床一种应用广泛的药物,它的一条合成路线如下:
)是临床一种应用广泛的药物,它的一条合成路线如下:

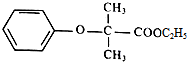 .
. 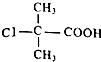 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$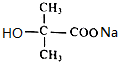 +NaCl+H2O.
+NaCl+H2O.