题目内容
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(3)下列哪些操作会使测定结果偏高
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
考点:中和滴定
专题:实验题
分析:(1)根据滴定管的精确度为0.01mL;
(2)先分析数据的可能性,误差太大的去掉,V(标准)取平均值,根据c(待测)=
计算;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=
分析误差.
(2)先分析数据的可能性,误差太大的去掉,V(标准)取平均值,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:
解:(1)记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图为24.90ml,滴定管中的液面读数为24.90ml-1.10ml=23.80mL,
故答案为:23.80mL;
(2)第二组读数误差太大舍去,标准液消耗的体积V(标准液)=
=26.10ml;根据c(待测)=
=0.1044mol?L-1;
故答案为:0.1044mol?L-1;
(3)A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;
D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;
故答案为:AC.
故答案为:23.80mL;
(2)第二组读数误差太大舍去,标准液消耗的体积V(标准液)=
| 26.11+26.31-0.22 |
| 2 |
| 0.1000mol/L×0.0261L |
| 0.025L |
故答案为:0.1044mol?L-1;
(3)A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;
D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;
故答案为:AC.
点评:本题考查了酸碱中和滴定操作、误差分析以及注意事项,热化学方程式的应用,难度不大,应注意相关知识的积累.

练习册系列答案
相关题目
常温时,下列三个反应都能向右进行:由此得出的正确结论是( )
2W-+X2═2X-+W2
2Y-+W2═2W-+Y2
2X-+Z2═2Z-+X2.
2W-+X2═2X-+W2
2Y-+W2═2W-+Y2
2X-+Z2═2Z-+X2.
| A、X-、Y-、Z-、W-中Z-的还原性最强 |
| B、X2、Y2、Z2、W2中Z2的氧化性最弱 |
| C、2Z-+Y2═2Y-+Z2不能向右进行 |
| D、还原性X->Y- |

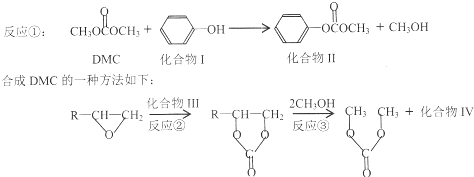
 与DMC1:1发生类似反应①的反应,请写出反应方程式
与DMC1:1发生类似反应①的反应,请写出反应方程式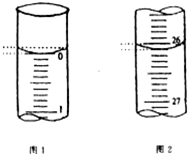 硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-
硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-

 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).
