题目内容
某课外学习小组为探究硫酸亚铁晶体(FeSO4?7H2O)制备及影响因素,进行如下实验.
Ⅰ.制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25mL 3mol?L-1硫酸,用酒精灯加热.
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体.产生该现象的原因是 (用化学方程式表示).
(2)制备过程中,铁需过量的原因是 .
Ⅱ.实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置.改进装置如图1(夹持和加热装置略去).
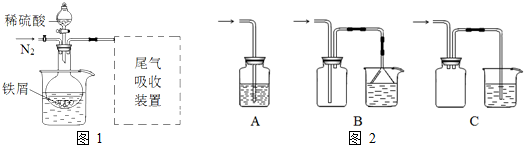
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 .
(4)调节pH=2目的是 .
(5)如图2装置适合尾气吸收的是 (填序号).
Ⅲ.晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体.准确称取晶体0.5000g置于锥形瓶中,加入10mL 3mol?L-1硫酸溶液和15mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol?L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90mL.(已知:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”).
②获得硫酸亚铁晶体的纯度为 .
Ⅰ.制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25mL 3mol?L-1硫酸,用酒精灯加热.
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体.产生该现象的原因是
(2)制备过程中,铁需过量的原因是
Ⅱ.实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置.改进装置如图1(夹持和加热装置略去).

(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是
(4)调节pH=2目的是
(5)如图2装置适合尾气吸收的是
Ⅲ.晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体.准确称取晶体0.5000g置于锥形瓶中,加入10mL 3mol?L-1硫酸溶液和15mL新煮沸过的蒸馏水进行溶解,立即用0.02000mol?L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90mL.(已知:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在
②获得硫酸亚铁晶体的纯度为
考点:制备实验方案的设计,探究物质的组成或测量物质的含量
专题:实验设计题
分析:I.(1)加热条件下,浓硫酸与Fe反应生成二氧化硫、硫酸铁和水;
(2)亚铁离子易被空气中的氧气氧化;
II.(3)水浴加热受热均匀,便于控制加热温度;
(4)亚铁离子水解显酸性,增大氢离子浓度水解平衡逆移;
(5)吸收尾气要防倒吸;
III.(6)①高锰酸钾具强氧化性,能腐蚀碱式滴定管中的橡胶管;
②根据消耗的高锰酸钾的体积求出其物质的量,再根据反应方程式求出硫酸亚铁的物质的量,然后求出质量和质量分数.
(2)亚铁离子易被空气中的氧气氧化;
II.(3)水浴加热受热均匀,便于控制加热温度;
(4)亚铁离子水解显酸性,增大氢离子浓度水解平衡逆移;
(5)吸收尾气要防倒吸;
III.(6)①高锰酸钾具强氧化性,能腐蚀碱式滴定管中的橡胶管;
②根据消耗的高锰酸钾的体积求出其物质的量,再根据反应方程式求出硫酸亚铁的物质的量,然后求出质量和质量分数.
解答:
解:I.(1),加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体,是因为加热条件下,浓硫酸与Fe反应生成二氧化硫、硫酸铁和水,其反应的化学方程式为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;
故答案为:2Fe+6H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O;
(2)亚铁离子易被空气中的氧气氧化,生成三价铁离子,加过量的铁粉,铁粉能把三价铁离子还原为亚铁离子,所以过量的铁粉防止Fe2+被氧化;
故答案为:防止Fe2+被氧化;
II.(3)用水浴加热时便于控制加热温度,烧瓶与水接触的地方均能被加热,而且加热温度相同,所以水浴加热可以使烧瓶受热均匀;
故答案为:均匀受热;
(4)亚铁离子水解显酸性,增大氢离子浓度水解平衡逆移,抑制亚铁离子水解,所以调节pH=2目的是抑制Fe2+的水解;
故答案为:抑制Fe2+的水解;
(5)二氧化硫易溶于水,吸收尾气要防倒吸,所以要选择BC;
故答案为:BC;
III.(6)①高锰酸钾具有强氧化性,能腐蚀碱式滴定管中的橡胶管,所以要用酸式滴定管量取;
故答案为:酸式;
②5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n(Fe2+) 0.02000mol?L-1×0.0169L
则n(Fe2+)=5mol×0.02000mol?L-1×0.0169L=0.00169mol,
硫酸亚铁晶体的纯度为:
×100%=93.96%;
故答案为:93.96%.
| ||
故答案为:2Fe+6H2SO4(浓)
| ||
(2)亚铁离子易被空气中的氧气氧化,生成三价铁离子,加过量的铁粉,铁粉能把三价铁离子还原为亚铁离子,所以过量的铁粉防止Fe2+被氧化;
故答案为:防止Fe2+被氧化;
II.(3)用水浴加热时便于控制加热温度,烧瓶与水接触的地方均能被加热,而且加热温度相同,所以水浴加热可以使烧瓶受热均匀;
故答案为:均匀受热;
(4)亚铁离子水解显酸性,增大氢离子浓度水解平衡逆移,抑制亚铁离子水解,所以调节pH=2目的是抑制Fe2+的水解;
故答案为:抑制Fe2+的水解;
(5)二氧化硫易溶于水,吸收尾气要防倒吸,所以要选择BC;
故答案为:BC;
III.(6)①高锰酸钾具有强氧化性,能腐蚀碱式滴定管中的橡胶管,所以要用酸式滴定管量取;
故答案为:酸式;
②5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5mol 1mol
n(Fe2+) 0.02000mol?L-1×0.0169L
则n(Fe2+)=5mol×0.02000mol?L-1×0.0169L=0.00169mol,
硫酸亚铁晶体的纯度为:
| 0.00169mol×278g/mol |
| 0.5g |
故答案为:93.96%.
点评:本题考查了物质制备方案设计,涉及物质之间的反应、盐的水解尾气处理、物质的量的计算和质量分数的求算等,题目难度中等,侧重于基础知识的综合应用的考查,注意对基础知识的积累.

练习册系列答案
相关题目
炼铁的总反应为 Fe2O3(s)+3CO(g)→2Fe(s)+3CO2(g)+Q kJ,可能发生了以下过程:
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
则Q与Q1、Q2、Q2的关系式正确的是( )
3Fe2O3(s)+CO(g)→2Fe3O4(s)+CO2(g)+Q1 kJ;
Fe3O4(s)+CO(g)→3FeO(s)+CO2(g)+Q2 kJ;
FeO(s)+CO(g)→Fe(s)+CO2(g)+Q3 kJ.
则Q与Q1、Q2、Q2的关系式正确的是( )
| A、Q=Q1+Q2+Q3 | ||
| B、Q=Q1-Q2-Q3 | ||
C、Q=
| ||
D、Q=
|
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
| B、78 g苯含有C=C双键的数目为3 NA |
| C、1 L 1 mol?L-1的NaClO溶液中含有ClO-的数目为NA |
| D、标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | -1 | +1 | -4 | -2 |
| A、丙的常见氧化物有两种 |
| B、气态氢化物稳定性:丁>戊 |
| C、丁的氧化物能与乙的氢化物的水溶液反应 |
| D、原子半径大小:丙<丁 |
下列关于化学用语的表示正确的是( )
A、碘化铵的电子式: |
B、间二甲苯的结构简式: |
| C、中子数为146、质子数为92的铀(U)原子:23892U |
D、氯原子的结构示意图: |
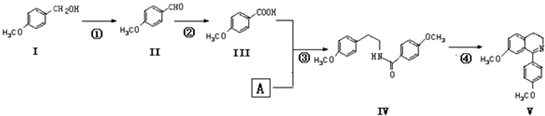
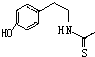 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).