题目内容
 硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-
硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-在一定体积的某维生素C溶液中加入1.2mol?L-1I2溶液25ml,充分反应后,用1.0mol?L-1Na2S2O3标准溶液滴定剩余的I2.请回答下列问题:
(1)配制100mL 1.0mol?L-1Na2S2O3标准溶液,使用的仪器除天平、药匙、胶头滴管外,还需要
(2)滴定时,可选择
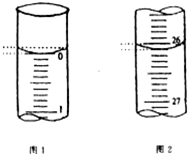
(3)若滴定开始和结束时,滴定管中的液面如图所示.反应消耗Na2S2O3标
准溶液的体积是
素C的物质的量:
(4)判断下列操作对该溶液中维生素C的物质的量测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,使测定结果
②若在滴定终点读取滴定管刻度时,仰视标准液液面,使测定结果
考点:中和滴定,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据配制100mL 1.0mol?L-1Na2S2O3标准溶液的步骤选择使用的仪器;
(2)碘单质遇到淀粉会变蓝色,可以用淀粉作指示剂;滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时碘单质被完全消耗,溶液蓝色褪去;
(3)根据滴定前和滴定后的读数计算;根据方程式计算维生素C的物质的量;
(4)①若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,则的Na2S2O3溶液浓度偏小,滴定时消耗的体积偏大;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则读数偏大,即消耗的Na2S2O3体积偏大.
(2)碘单质遇到淀粉会变蓝色,可以用淀粉作指示剂;滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时碘单质被完全消耗,溶液蓝色褪去;
(3)根据滴定前和滴定后的读数计算;根据方程式计算维生素C的物质的量;
(4)①若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,则的Na2S2O3溶液浓度偏小,滴定时消耗的体积偏大;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则读数偏大,即消耗的Na2S2O3体积偏大.
解答:
解:(1)根据配制100mL 1.0mol?L-1Na2S2O3标准溶液的步骤可知,配制过程中使用的仪器有:托盘天平(砝码、镊子)、药匙、量筒、100mL容量瓶、胶头滴管、烧杯、玻璃棒,所以还缺少烧杯和玻璃棒,
故答案为:100mL容量瓶、烧杯、玻璃棒;
(2)在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,碘单质遇到淀粉会变蓝色,可以用淀粉作指示剂;滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时碘单质被完全消耗,溶液蓝色褪去并且半分钟内不恢复;
故答案为:淀粉溶液;锥形瓶内溶液颜色的变化;当滴入最后一滴滴定溶液,溶液蓝色褪去,且半分钟内不恢复蓝色;
(3)由图可知滴定前读数为0,滴定后的读数为26.10ml,则反应消耗Na2S2O3标准溶液的体积是26.10mL,则n(Na2S2O3)=1.0mol?L-1×0.0261L=0.0261mol,
由2S2O32-+I2═S4O62-+2I-可知,消耗的单质碘为n(I2)=
n(Na2S2O3)=0.01305mol,则与维生素反应的单质碘为1.2mol?L-1×0.02500L-0.01305mol=0.01695mol,由C6H8O6+I2═C6H6O6+2H++2I-可知n(C6H8O6)=0.01695mol≈0.017mol;
故答案为:26.10mL;0.017;
(4)①若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,则的Na2S2O3溶液浓度偏小,滴定时消耗的体积偏大,计算得到的与Na2S2O3溶液反应的碘的物质的量偏大,则与维生素C反应的碘的物质的量偏小,所以求出的维生素C的物质的量偏小,故答案为:偏低;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则读数偏大,即消耗的Na2S2O3体积偏大,计算得到的与Na2S2O3溶液反应的碘的物质的量偏大,则与维生素C反应的碘的物质的量偏小,所以求出的维生素C的物质的量偏小,故答案为:偏低.
故答案为:100mL容量瓶、烧杯、玻璃棒;
(2)在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,碘单质遇到淀粉会变蓝色,可以用淀粉作指示剂;滴定时,眼睛要注视锥形瓶内溶液的颜色变化;滴定终点时碘单质被完全消耗,溶液蓝色褪去并且半分钟内不恢复;
故答案为:淀粉溶液;锥形瓶内溶液颜色的变化;当滴入最后一滴滴定溶液,溶液蓝色褪去,且半分钟内不恢复蓝色;
(3)由图可知滴定前读数为0,滴定后的读数为26.10ml,则反应消耗Na2S2O3标准溶液的体积是26.10mL,则n(Na2S2O3)=1.0mol?L-1×0.0261L=0.0261mol,
由2S2O32-+I2═S4O62-+2I-可知,消耗的单质碘为n(I2)=
| 1 |
| 2 |
故答案为:26.10mL;0.017;
(4)①若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,则的Na2S2O3溶液浓度偏小,滴定时消耗的体积偏大,计算得到的与Na2S2O3溶液反应的碘的物质的量偏大,则与维生素C反应的碘的物质的量偏小,所以求出的维生素C的物质的量偏小,故答案为:偏低;
②若在滴定终点读取滴定管刻度时,仰视标准液液面,则读数偏大,即消耗的Na2S2O3体积偏大,计算得到的与Na2S2O3溶液反应的碘的物质的量偏大,则与维生素C反应的碘的物质的量偏小,所以求出的维生素C的物质的量偏小,故答案为:偏低.
点评:本题考查了物质含量的测定、滴定实验的步骤和终点判断方法、定量计算应用等,侧重于考查学生的实验能力和分析能力,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
同温同压下,气体的密度之比等于相对分子质量之比,已知空气的平均相对分子质量为29,同温同压下,下列气体的密度比空气密度小的是( )
| A、二氧化氮 | B、二氧化碳 |
| C、二氧化硫 | D、一氧化碳 |
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | -1 | +1 | -4 | -2 |
| A、丙的常见氧化物有两种 |
| B、气态氢化物稳定性:丁>戊 |
| C、丁的氧化物能与乙的氢化物的水溶液反应 |
| D、原子半径大小:丙<丁 |
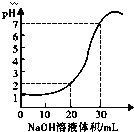 如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )
如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )| A | B | C | D | |
| x | 0.12 | 0.04 | 0.03 | 0.09 |
| y | 0.04 | 0.12 | 0.09 | 0.03 |
| A、A | B、B | C、C | D、D |
关于
C的说法正确的是( )
| 12 |
| 6 |
| A、质量数为6 |
| B、质子数为6 |
| C、电子数为13 |
| D、中子数为6 |
能再溶液中大量共存的一组离子是( )
| A、Na+、Ba2+、OH-、NO3- |
| B、Al3+、NH4+、OH-、Cl- |
| C、K+、Na+、ClO-、SO32- |
| D、H+、Na+、AlO2-、Cl- |
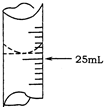 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
 与1分
与1分 在一定条件下可发生类似反应①的反应,生成有机化合物Ⅵ,Ⅵ的结构简式为
在一定条件下可发生类似反应①的反应,生成有机化合物Ⅵ,Ⅵ的结构简式为 二甲醚是一种重要的清洁燃料,有多种合成方法.
二甲醚是一种重要的清洁燃料,有多种合成方法.