题目内容
亚硝酸钠(NaN02)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组拟制备NaN02并测定产品纯度.
I【查阅资料】
①2NO+Na202=2NaN02;2N02+Na202=2NaN03.
②NO能被酸性高锰酸钾氧化成NO3-.
③酸性条件下MnO4-被还原为Mn2+
Ⅱ【制备产品】
用如下装置制NaN02(夹持和加热装置已省略).

(1)装置A烧瓶中发生反应的化学方程式为
(2)B装置的作用是
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是 .(填字母编号)
A.浓H2S04 B.碱石灰 c.无水CaCl2 D?生石灰
Ⅲ【测定浓度】:设计如下方案测定产品的纯度.
样品
溶液A
溶液B
溶液B数据处理
(4)溶液A到溶液B发生反应的离子方程式为 .
(5)取样品2.3g经一系列操作后得到湾液A.100mL,准确量取10.OOmL A与24.OOmL 0.05mol/L的酸性KMn04溶液在锥形瓶中充分反应.反应后溶液用O.1mol/L(NH4)2Fe(S04)2.准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(S04)2溶液lO.00mL,则样品中NaN02的纯度为 .
Ⅳ【探究反思】.
(6)NaN02的纯度偏低,该小组讨论提出的原因中可能正确的是 .(填字母编号)
A.滴定至溶液紫色刚刚好褪去并且嗽贤.
B.加入A与KMn04溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长.
I【查阅资料】
①2NO+Na202=2NaN02;2N02+Na202=2NaN03.
②NO能被酸性高锰酸钾氧化成NO3-.
③酸性条件下MnO4-被还原为Mn2+
Ⅱ【制备产品】
用如下装置制NaN02(夹持和加热装置已省略).

(1)装置A烧瓶中发生反应的化学方程式为
(2)B装置的作用是
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是
A.浓H2S04 B.碱石灰 c.无水CaCl2 D?生石灰
Ⅲ【测定浓度】:设计如下方案测定产品的纯度.
样品
| 一系列 |
| 操作 |
| ①酸性高锰酸钾 |
| ②(NH4)2Fe(SO4)2 |
| 标准溶液滴定 |
(4)溶液A到溶液B发生反应的离子方程式为
(5)取样品2.3g经一系列操作后得到湾液A.100mL,准确量取10.OOmL A与24.OOmL 0.05mol/L的酸性KMn04溶液在锥形瓶中充分反应.反应后溶液用O.1mol/L(NH4)2Fe(S04)2.准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(S04)2溶液lO.00mL,则样品中NaN02的纯度为
Ⅳ【探究反思】.
(6)NaN02的纯度偏低,该小组讨论提出的原因中可能正确的是
A.滴定至溶液紫色刚刚好褪去并且嗽贤.
B.加入A与KMn04溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
(2)B装置中,NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO;
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2;
(4)根据2NO+Na202=2NaN02,可知溶液A含有NO2-,高锰酸钾具有氧化性,能将NO2-氧化为NO3-,反应的实质是:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;
(5)根据5(NH4)2 Fe(S04)2~MnO4-,消耗n(KMn04)=0.1mol/L×0.01L=0.001mol,
根据 2MnO4-~5NO2-,计算样品中NaN02的纯度;
(6)A.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(S04)2偏小,导致的量结果偏高;
B.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响;
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(S04)2被氧化,消耗的(NH4)2 Fe(S04)2偏大,导致的量结果偏低.
| ||
(2)B装置中,NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO;
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2;
(4)根据2NO+Na202=2NaN02,可知溶液A含有NO2-,高锰酸钾具有氧化性,能将NO2-氧化为NO3-,反应的实质是:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;
(5)根据5(NH4)2 Fe(S04)2~MnO4-,消耗n(KMn04)=0.1mol/L×0.01L=0.001mol,
根据 2MnO4-~5NO2-,计算样品中NaN02的纯度;
(6)A.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(S04)2偏小,导致的量结果偏高;
B.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响;
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(S04)2被氧化,消耗的(NH4)2 Fe(S04)2偏大,导致的量结果偏低.
解答:
解:(1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
(2)B装置中,NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO,故答案为:将NO2转化为NO,同时铜与稀硝酸反应生成NO;
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2,故答案为:BD;
(4)根据2NO+Na202=2NaN02,可知溶液A含有NO2-,高锰酸钾具有氧化性,能将NO2-氧化为NO3-,反应的实质是:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-,故答案为:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;
(5)根据5(NH4)2 Fe(S04)2~MnO4-,消耗n(KMn04)=0.1mol/L×0.01L=0.001mol,
2MnO4-~5NO2-,
2 5
0.05mol/L×0.024L-0.001mol x,
x=0.0005mol,100mL中n(NaN02)=0.0005mol×
=0.005mol,
则样品中NaN02的纯度为
×100%=75%,
故答案为:75%;
(6)A.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(S04)2偏小,导致的量结果偏高,故A错误;
B.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响,故B错误;
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(S04)2被氧化,消耗的(NH4)2 Fe(S04)2偏大,导致的量结果偏低,故C正确;
故答案为:C.
| ||
| ||
(2)B装置中,NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO,故答案为:将NO2转化为NO,同时铜与稀硝酸反应生成NO;
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2,故答案为:BD;
(4)根据2NO+Na202=2NaN02,可知溶液A含有NO2-,高锰酸钾具有氧化性,能将NO2-氧化为NO3-,反应的实质是:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-,故答案为:2MnO4-+5NO2-+6H+=2Mn2++3H2O+5NO3-;
(5)根据5(NH4)2 Fe(S04)2~MnO4-,消耗n(KMn04)=0.1mol/L×0.01L=0.001mol,
2MnO4-~5NO2-,
2 5
0.05mol/L×0.024L-0.001mol x,
x=0.0005mol,100mL中n(NaN02)=0.0005mol×
| 100mL |
| 10mL |
则样品中NaN02的纯度为
| 0.005mol×69g/mol |
| 2.3g |
故答案为:75%;
(6)A.滴定至溶液紫色刚刚好褪去,消耗的(NH4)2 Fe(S04)2偏小,导致的量结果偏高,故A错误;
B.加入A与KMn04溶液前锥形瓶未经干燥,对测量结果无影响,故B错误;
C.实验中使用的(NH4)2Fe(S04)2溶液暴露在空气中时间过长,部分(NH4)2 Fe(S04)2被氧化,消耗的(NH4)2 Fe(S04)2偏大,导致的量结果偏低,故C正确;
故答案为:C.
点评:本题是一道实验方案的设计和探究题,考查学生分析和解决问题的能力,综合性强,难度大.

练习册系列答案
相关题目
下列关于化学用语的表示正确的是( )
A、碘化铵的电子式: |
B、间二甲苯的结构简式: |
| C、中子数为146、质子数为92的铀(U)原子:23892U |
D、氯原子的结构示意图: |
下列关于铝及其化合物的说法正确的是( )
| A、在常温下,浓硝酸不可储存在铝制容器中 |
| B、要从铝土矿中提取铝,必须获得较高纯度的氧化铝 |
| C、铝具有良好的抗腐蚀性,说明铝在空气中不易于氧气发生反应 |
| D、Al、Al2O3、AlCl3都既能和稀盐酸反应,又能和氢氧化钠溶液反应 |
能再溶液中大量共存的一组离子是( )
| A、Na+、Ba2+、OH-、NO3- |
| B、Al3+、NH4+、OH-、Cl- |
| C、K+、Na+、ClO-、SO32- |
| D、H+、Na+、AlO2-、Cl- |
除去Fe2O3中混有的少量Al2O3,可选用的溶液是( )
| A、盐酸 | B、稀硝酸 |
| C、氨水 | D、氢氧化钠溶液 |
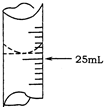 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
 的邻位异构体分子内脱水产物,香豆素的结构简式为
的邻位异构体分子内脱水产物,香豆素的结构简式为
 在一定条件下可水解为
在一定条件下可水解为 ;则F
;则F 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.