题目内容
用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000mL溶液.除烧杯外,还需要的玻璃仪器有 、 、
(2)滴定:
①盛装0.1000mol?L-1盐酸标准液应该使用 式滴定管.
②滴定时双眼应 .
③有关数据记录如下:
(3)计算纯度:烧碱样品的纯度是 .
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果 ;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
③读数时,滴定前仰视,滴定后俯视,则会使测定结果 .
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000mL溶液.除烧杯外,还需要的玻璃仪器有
(2)滴定:
①盛装0.1000mol?L-1盐酸标准液应该使用
②滴定时双眼应
③有关数据记录如下:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 1.20 | 21.20 |
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果
③读数时,滴定前仰视,滴定后俯视,则会使测定结果
考点:中和滴定
专题:实验题
分析:(1)配制1000mL一定物质的量浓度的氢氧化钠溶液需要仪器:1000mL容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙等;
(2)①酸性溶液应用酸式滴定管盛放;
②滴定时眼睛注视锥形瓶中颜色变化;
(3)先分析数据求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量;
②滴定过程中不慎将酸滴在瓶外,盐酸消耗的体积偏多;
③滴定前仰视、滴定后俯视,盐酸体积偏小;
(2)①酸性溶液应用酸式滴定管盛放;
②滴定时眼睛注视锥形瓶中颜色变化;
(3)先分析数据求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量;
②滴定过程中不慎将酸滴在瓶外,盐酸消耗的体积偏多;
③滴定前仰视、滴定后俯视,盐酸体积偏小;
解答:
解:(1)配制1000mL一定物质的量浓度的氢氧化钠溶液需要仪器:1000mL容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙,除烧杯外,所以配制待测液还需要的玻璃仪器有1000mL容量瓶、玻璃棒、胶头滴管;
故答案为:1000mL容量瓶、玻璃棒、胶头滴管;
(2))①盛装0.1000mol?L-1盐酸标准液应该使用酸式滴定管;
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化;
故答案为:酸; 注意观察锥形瓶内溶液颜色的变化;
(3)两次消耗盐酸体积分别为:20.50ml-0.50ml=20.00ml、21.20ml-1.20ml=20.00ml,两消耗盐酸的平均体积为20.00mL,
NaOH~~~~~HCl
1 1
n(NaOH) 0.1000mol?L-1×0.020L
n(NaOH)=0.0020mol,即20.00mL待测溶液含有m(烧碱)═nM═0.0020mol×40g/mol=0.80g,所以1000mL待测溶液含有m(烧碱)═0.80g×50=4.00g,烧碱的纯度ω(烧碱)=
×100%=80%,
故答案为:80%;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量,不会影响测定结果,故答案为:无影响;
②滴定过程中不慎将酸滴在瓶外,盐酸消耗的体积偏多,测定结果偏大,故答案为:偏高;
③读数时,滴定前仰视,滴定后俯视,盐酸体积变小,结果偏低,故答案为:偏低.
故答案为:1000mL容量瓶、玻璃棒、胶头滴管;
(2))①盛装0.1000mol?L-1盐酸标准液应该使用酸式滴定管;
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化;
故答案为:酸; 注意观察锥形瓶内溶液颜色的变化;
(3)两次消耗盐酸体积分别为:20.50ml-0.50ml=20.00ml、21.20ml-1.20ml=20.00ml,两消耗盐酸的平均体积为20.00mL,
NaOH~~~~~HCl
1 1
n(NaOH) 0.1000mol?L-1×0.020L
n(NaOH)=0.0020mol,即20.00mL待测溶液含有m(烧碱)═nM═0.0020mol×40g/mol=0.80g,所以1000mL待测溶液含有m(烧碱)═0.80g×50=4.00g,烧碱的纯度ω(烧碱)=
| 4.00g |
| 5.00g |
故答案为:80%;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量,不会影响测定结果,故答案为:无影响;
②滴定过程中不慎将酸滴在瓶外,盐酸消耗的体积偏多,测定结果偏大,故答案为:偏高;
③读数时,滴定前仰视,滴定后俯视,盐酸体积变小,结果偏低,故答案为:偏低.
点评:本题考查了滴定操作.操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

练习册系列答案
相关题目
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | -1 | +1 | -4 | -2 |
| A、丙的常见氧化物有两种 |
| B、气态氢化物稳定性:丁>戊 |
| C、丁的氧化物能与乙的氢化物的水溶液反应 |
| D、原子半径大小:丙<丁 |
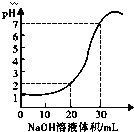 如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )
如图为10mL x mol?L-1的盐酸用y mol?L-1的NaOH溶液滴定的图象,依据图象推出x和y的数值可能是下列各组中的( )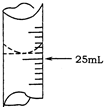 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).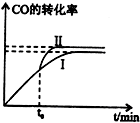 二甲醚是一种重要的清洁燃料,有多种合成方法.
二甲醚是一种重要的清洁燃料,有多种合成方法.
 的邻位异构体分子内脱水产物,香豆素的结构简式为
的邻位异构体分子内脱水产物,香豆素的结构简式为