题目内容
1.实验室检验溶液中是否存在SO42-,可选用的化学试剂依次为( )| A. | KCl(aq),HCl(aq) | B. | HNO3(aq),KNO3(aq) | C. | HCl(aq),BaCl2(aq) | D. | NaNO3(aq),HNO3(aq) |
分析 在检验SO42-时,加入氯化钡之前要先加盐酸以排除Ag+、CO32-离子的干扰,以此解答该题.
解答 解:检验 SO42- 时要避免 SO32- 的影响,就不要加入稀硝酸,因为稀硝酸能把SO32- 氧化为SO42-,从而干扰SO42- 的检验;要先加入过量稀盐酸,以除去 SO32-、CO32- 等离子的影响,同时,当加入稀盐酸时没有沉淀,可排除Cl-的影响.当然,若溶液中不含SO32-离子,则加入稀硝酸也可.检验SO42-可用BaCl2溶液,看有没有白色沉淀产生.综上分析可知,检验某溶液中是否含有SO42-的操作方法是:首先在试液中加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-.
故选C.
点评 本题考查了硫酸根离子的检验,侧重于学生的分析、实验能力的考查,掌握常见离子的检验方法是解答的关键,注意排除其它离子的干扰,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.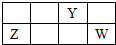 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )| A. | ZY晶体熔化、ZCl3溶于水破坏的化学键种类相同 | |
| B. | 化合物YCl3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 | |
| C. | 元素R与W同主族,且原子序数小于W.因为R的非金属性强于W,所以X2R的沸点高于X2W | |
| D. | Z2W3固体可由溶液中复分解反应制得 |
16.有机物X的分子式为C6H12O2,其水解可得到CH3OH,则X的结构有(考虑立体异构)( )种.
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9. X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y位于元素周期表第三周期第VIA族,Y和Z的最高价氧化物对应的水化物的酸性较强的是HClO4(写化学式).
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子价电子排布式是3d104s1.
工业上以W2Y为原料制备W的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2Cu+2SO2 ,通过该方法冶炼得到的W的单质含有锌、铁、镍、银、金等杂质,除去这些杂质常用的方法叫电解精炼,请标出右图所示装置中电极材料名称及电解质溶液名称.
(4)W形成的氧化物W2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个W原子.
 X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的分子中存在2个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是H-S.
(3)W的基态原子价电子排布式是3d104s1.
工业上以W2Y为原料制备W的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2Cu+2SO2 ,通过该方法冶炼得到的W的单质含有锌、铁、镍、银、金等杂质,除去这些杂质常用的方法叫电解精炼,请标出右图所示装置中电极材料名称及电解质溶液名称.
(4)W形成的氧化物W2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个W原子.
10.关于电化学的下列说法正确的是( )


| A. | 工业上用电解MgCl2溶液的方法冶炼Mg | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 如图中发生反应的方程式为:Fe+2H+=Fe2++H2↑ | |
| D. | 碱性锌锰干电池放电时的正极反应为:MnO2+H2O+e-=MnOOH+OH- |
11.下列各示意图与对应的表述不正确的是( )
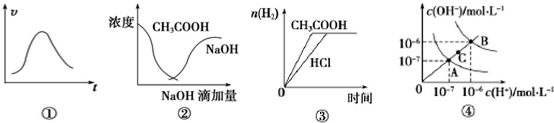

| A. | 图①可表示一定条件下,锌和稀硫酸反应的速率随时间变化的趋势图 | |
| B. | 图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液中浓度的变化趋势图 | |
| C. | 图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量变化 | |
| D. | 图④为水的电离平衡曲线图,若从A点到C点,可采用升高温度的方法 |
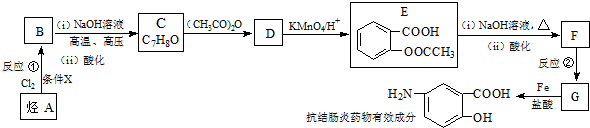
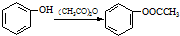
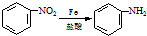
 ;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应;
;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应; ;
;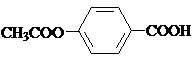 ,
, ;
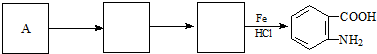
;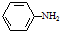 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(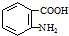 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)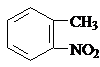 ,
,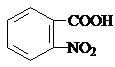 .
.
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题: