题目内容
15.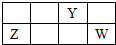 短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )
短周期元素X、Y、Z、W的原子序数依次增大,X、Y原子最外层电子数之和等于W原子最外层电子数,Y、Z的最高正化合价之和为8.部分元素在周期表中的相对位置如右图所示.下列说法中正确的是( )| A. | ZY晶体熔化、ZCl3溶于水破坏的化学键种类相同 | |
| B. | 化合物YCl3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 | |
| C. | 元素R与W同主族,且原子序数小于W.因为R的非金属性强于W,所以X2R的沸点高于X2W | |
| D. | Z2W3固体可由溶液中复分解反应制得 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,由位置可知,Y为第二周期元素,Y、Z的最高正化合价之和为8,Y为N,Z为Al,结合位置可知W为S;X、Y原子最外层电子数之和等于W原子最外层电子数,则X的最外层电子数为6-5=1,且X的原子序数小于Y,则X为H,然后结合元素周期律及元素化合物知识来解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,由位置可知,Y为第二周期元素,Y、Z的最高正化合价之和为8,Y为N,Z为Al,结合位置可知W为S;X、Y原子最外层电子数之和等于W原子最外层电子数,则X的最外层电子数为6-5=1,且X的原子序数小于Y,则X为H,
A.ZY晶体为原子晶体,熔化破坏共价键、ZCl3溶于水发生电离,破坏共价键,化学键种类相同,故A正确;
B.化合物NCl3水解产物有硝酸,具有强氧化性,由此可知Y在该化合物中的化合价为-3,故C错误;
C.元素R与W同主族,且原子序数小于W,可知R为O,X2R的沸点高于X2W,与水分子间含氢键有关,与非金属性无关,故C错误;
D.因铝离子与硫离子在溶液中相互促进水解,则Z2W3固体不能由溶液中复分解反应制得,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意AlN为原子晶体、水解原理应用等为解答的难点,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
5.Salvinorin A的结构简式如图所示,下列说法不正确的是( )
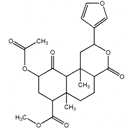

| A. | 分子中含有6个手性碳原子 | |
| B. | 能使酸性高锰酸溶液褪色 | |
| C. | 1mol该有机物最多可与含3molNaOH的水溶液反应 | |
| D. | 1mol该有机物最多可与3molH2加成 |
6.由铜、锌和稀硫酸组成的原电池工作时,下列说法正确的是( )
| A. | 电能转化为化学能 | B. | 铜片上产生大量的气泡 | ||
| C. | 原电池中锌是正极,发生氧化反应 | D. | 溶液的pH值减小 |
7.已知维生素 A 的结构简式如下,有关它的说法正确的是 ( )


| A. | 维生素A是一种易溶于水的醇 | |
| B. | 维生素A的一个分子中含有5个碳碳双键 | |
| C. | 维生素A具有环己烷的结构单元 | |
| D. | 维生素A能发生加成、氧化、酯化等反应 |
4.全世界各国运动会上都禁止运动员服用兴奋剂,这是保证公正公平的基本要求;如图是某种兴奋剂的结构简式,有关该物质的说法正确的是 ( )

| A. | 该分子中所有碳原子一定都在一个平面上 | |
| B. | 该分子遇FeCl3溶液显紫色,但与苯酚不属于同系物 | |
| C. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键. |
1.实验室检验溶液中是否存在SO42-,可选用的化学试剂依次为( )
| A. | KCl(aq),HCl(aq) | B. | HNO3(aq),KNO3(aq) | C. | HCl(aq),BaCl2(aq) | D. | NaNO3(aq),HNO3(aq) |
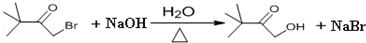 .
.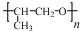 ,则该同分异构体的结构简式为:
,则该同分异构体的结构简式为: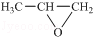 .
.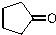 )来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为:
)来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为: .
.