题目内容
4.实验室现要制取一瓶纯净干燥的氯气.现有如图仪器和药品可供使用: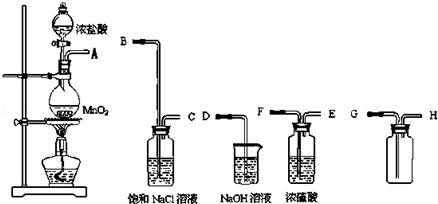
(1)实验室制取氯气的原理:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O(写出化学方程式)其中HCl所表现的性质是还原性和酸性.(填“氧化性”或者“还原性”)
(2)连接上述仪器的正确顺序是B
A.ABCEFGHD B.ABCFEGHD
C.AFEBCGHD D.AFEBCHGD
(3)说明以上装置中所装溶液的作用.饱和食盐水的作用是B;浓硫酸的作用是A;氢氧化钠的作用是C.(填序号)
A.除去氯气中的水蒸气 B.除去氯气中氯化氢 C.尾气吸收 D.收集氯气.
分析 (1)实验室是用二氧化锰和浓盐酸反应制氯气,反应生成氯气、二氯化锰、水;
(2)根据实验的目的和反应的原理可知,实验室用第一个装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置吸收氯气;
(3)根据氯化氢和氯气、水蒸气、浓硫酸、饱和食盐水的性质分析试剂的作用;多余的氯气用氢氧化钠溶液吸收.
解答 解:(1)实验室是用二氧化锰和浓盐酸反应制氯气发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中,Mn元素的化合价降低,Cl元素得化合价升高,则MnO2为氧化剂,HCl为还原剂,由方程式可知,二氯化锰中氯的化合价未变,所以,盐酸在反应中起到酸性和还原剂的作用,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;还原性;
(2)实验室用第一个装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶和盛有浓硫酸的洗气瓶,除杂干燥后用向上排空法收集氯气,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置吸收,
所以正确的顺序为:ABCFEGHD,故选:B;
(3)盐酸易挥发,所以制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,饱和食盐水中含有氯离子,能抑制氯气的溶解,所以饱和食盐水的作用是除去氯化氢杂质气体;浓硫酸常常干燥能干燥中性、酸性气体,故选浓硫酸干燥氯气,多余的氯气用氢氧化钠溶液吸收,
故答案为:B;A;C.
点评 本题考查了制取氯气实验相关内容的探究,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累,题目难度中等.

| A. | 强电解质在熔化状态下一定能够导电 | |
| B. | 离子化合物一定是强电解质 | |
| C. | 具有强极性键的共价化合物是强电解质 | |
| D. | 强电解质水溶液一定具有很强的导电能力 |
| A. | 1molNa参加氧化还原反应时转移电子数为NA | |
| B. | 3.2gSO2与2.3gNO2所含有的氧原子数相等 | |
| C. | 1molNa2O2与足量水反应后转移的电子数为2NA | |
| D. | 1L0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
| A. | C | B. | Ti | C. | Cl | D. | Ti和C |
| A. | 结构相似的分子晶体的溶沸点,与相对分子质量呈正相关,所以HF<HCl | |
| B. | Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大 | |
| C. | 在分子中,两个原子间的键长越长,键能越大 | |
| D. | 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大 |
| A. | 1mol N2中含有的电子数为2NA | |
| B. | 标准状态下,22.4L水所含的氧原子数为NA | |
| C. | 23g钠在化学反应中失去电子数目为10 NA | |
| D. | 2g氢气所含的氢原子数为2NA |
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ |