题目内容
9.下列有关元素或者化合物性质的比较中,正确的是( )| A. | 结构相似的分子晶体的溶沸点,与相对分子质量呈正相关,所以HF<HCl | |
| B. | Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大 | |
| C. | 在分子中,两个原子间的键长越长,键能越大 | |
| D. | 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大 |
分析 A.HF分子间存在氢键,则氟化氢的熔沸点大于HCl;
B.三者的电子层相同,核电荷数越大,原子半径越小;
C.在分子中,两个原子间的键长越长,键能越小;
D.离子晶体中,晶格能越高,其熔点越高、硬度越大.
解答 解:A.由于HF分子间存在氢键,大大增加了其分子间作用力,则氟化氢的熔沸点大于HCl,故A错误;
B.Na、Mg、Al原子最外层电子数依次增多,原子半径也依次减小,故B错误;
C.在分子中,两个原子间的键长越长,键能越小,形成的键越不稳定,故C错误;
D.对应离子晶体,晶格能越高,则离子晶体的熔点越高、硬度越大,故D正确;
故选D.
点评 本题考查较为综合,涉及氢键、粒子比较大小比较、离子晶体性质、共价键性质等知识,题目难度中等,明确晶体类型及性质为解答关键,注意掌握氢键特点及物质对熔沸点影响.

练习册系列答案
相关题目
19.关于Na2CO3和NaHCO3的叙述正确的是( )
| A. | NaHCO3和Na2CO3均能和BaCl2反应 | |
| B. | NaHCO3和Na2CO3都能加热分解,产生使石灰水变浑浊的气体 | |
| C. | 质量相同的NaHCO3和Na2CO3分别与足量稀盐酸反应,NaHCO3放出气体多 | |
| D. | 可以用澄清石灰水来鉴别Na2CO3NaHCO3溶液 |
20. 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )| 编号 | 1 | 2 | 3 | 4 |
| 气体M | H2S | NH3 | NO | H2 |
| 气体N | SO2 | HCl | O2 | Cl2 |
| A. | ①②③④ | B. | ②④①③ | C. | ④③①② | D. | ①④③② |
17.常温下,下列说法不正确的是( )
| A. | 在0.1mol/L的HNO3溶液中由水电出的c(H+)<$\sqrt{{K}_{W}}$ | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+)=c(CH3COO-) | |
| C. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) |
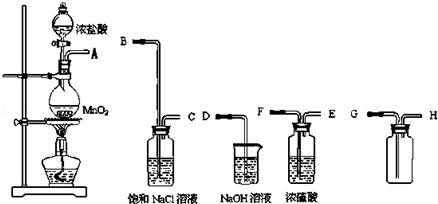
14.下列装置或操作能达到实验目的是( )


| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁将饱和食盐水完全蒸干制NaCl |