题目内容
10.已知元素A~E表示元素周期表中短周期的四种元素,请根据表中信息回答下列问题.| 元素 | 性质或结构信息 |
| A | 组成有机物的必须元素 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
(2)用电子式表示元素B形成的10e-的氢化物分子的形成过程
 .
.(3)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为
 .
.(4)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是离子化合物(填“共价化合物”或“离子化合物”),甲中的化学键类型为离子键、共价键.
(5)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(6)元素D的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式H2O2+H2S=S↓+2H2O.
分析 元素A~E表示元素周期表中短周期的四种元素,A是组成有机物的必须元素,则A为碳元素;B元素原子最外层电子数是电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;工业上通过分离液态空气获得C元素单质,原子的最外层电子数是内层电子总数的2.5倍,则C为N元素;D的单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里,则D为S元素;E元素最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子,则E为Na.
解答 解:元素A~E表示元素周期表中短周期的四种元素,A是组成有机物的必须元素,则A为碳元素;B元素原子最外层电子数是电子层数的3倍,原子只能有2个电子层,最外层电子数为6,故B为O元素;工业上通过分离液态空气获得C元素单质,原子的最外层电子数是内层电子总数的2.5倍,则C为N元素;D的单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里,则D为S元素;E元素最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子,则E为Na.
(1)A为碳元素,在元素周期表中的位置为:第二周期第ⅣA族,元素A的一种同位素可测定文物年代,这种同位素的符号是146C,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+,
故答案为:第二周期第ⅣA族;146C;S2->O2->Na+;
(2)元素B形成的10e-的氢化物分子为H2O,用电子数表示形成过程: ,
,
故答案为: ;
;
(3)已知E在B的单质中燃烧生成淡黄色的固体为Na2O2,该固体化合物的电子式为 ,故答案为:
,故答案为: ;
;
(4)C的氢化物和C的最高价氧化物的水化物反应生成甲为NH4NO3,甲是离子化合物,甲中的化学键类型为离子键、共价键,故答案为:离子化合物;离子键、共价键;
(5)A的单质为硫,D的最高价含氧酸为硫酸,二者反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(6)元素D的气态氢化物为硫化氢,与过氧化氢溶液混合后有浅黄色固体生成,反应生成硫水水,发生的化学方程式:H2O2+H2S=S↓+2H2O,
故答案为:H2O2+H2S=S↓+2H2O.
点评 本题考查结构性质物质关系应用,推断元素是解题关键,注意对元素化合物性质的掌握,掌握电子层表示化学键或物质的形成.

| A. | 中和滴定盛待测液的锥形瓶中有少量水对滴定结果无影响,锥形瓶不能用待测液润洗 | |
| B. | 酸式和碱式滴定管用蒸馏水洗净后还需用标准液或待测液润洗 | |
| C. | 滴定时左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶中颜色变化 | |
| D. | 滴定前仰视读数,滴定后平视刻度读数,被测待测溶液偏高 |
| A. | H2O | B. | CaCl2 | C. | CaO2 | D. | Cl2 |
| A. | 锕系元素 | B. | 金属元素 | C. | 镧系元素 | D. | 第六周期元素 |
| A. | 单质碘 | B. | 氯化镁 | C. | 溴化钾 | D. | 氯化铵 |
| A. | 原子核 | B. | 化学键 | C. | 物质的存在状态 | D. | 物质的颜色 |

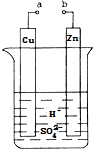 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置: