题目内容
20.食盐是日常生活的必需品,也是重要的化工原料.粗盐中常含有少量泥沙及Ca2+、Mg2+、SO42-等杂质离子.为除去粗严重的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
(1)为除去Ca2+、Mg2+、SO42-,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量);
A.Na2CO3 B.BaCl2 C.NaOH
加入的顺序为BCA(CBA或BAC)(填字母标号).
(2)请写出步骤⑥中涉及反应的离子方程式CO32-+2H+=H2O+CO2↑;OH-+H+=H2O.
(3)粗盐提纯的整个操作过程中多处使用到玻璃棒,步骤⑦蒸发过程中使用玻璃棒的作用是搅拌,防止局部过热使液体飞测.
(4)若先加盐酸再过滤,将对提纯效果产生影响,其原因是在酸性条件下会有部分沉淀溶解,从而影响精盐的纯度.
分析 粗盐中含难溶的泥沙以及可溶性杂质(钙离子、镁离子、硫酸根),通过第①步溶解,再通过第②③④步添加除掉可溶性杂质的试剂,将钙离子、镁离子、硫酸根离子沉淀下来,再过滤,便可除掉难溶性杂质泥沙,还有可溶性杂质也转化成了难溶的沉淀;由于除杂试剂是过量的,所以滤液中含杂质:CO32-、OH-,用盐酸与之反应除去,当然盐酸也是过量的,盐酸易挥发,在第⑦步中除去.
解答 解:(1)碳酸钠必须在氯化钡的后面,原因是过量的碳酸根既保证除掉前面过量的钡离子,又保证了过量的碳酸根在第⑥步除去,NaOH无先后顺序,所以加入的顺序可以是①BaCl2、Na2CO3、NaOH;②BaCl2、NaOH、Na2CO3;③NaOH、BaCl2、Na2CO3;
故答案为:BCA(CBA或BAC);
(2)滤液中含杂质:过量的CO32-、OH-,盐酸中的氢离子与碳酸根反应生成二氧化碳和水,氢离子与氢氧根反应生成水.
故答案为:CO32-+2H+=H2O+CO2↑; OH-+H+=H2O;
(3)蒸发结晶实验中,持续加热,玻璃棒的作用是搅拌,防止局部过热使液体飞测.
故答案为:搅拌,防止局部过热使液体飞测;
(4)产生的沉淀有氢氧化镁、碳酸钙、硫酸钡、碳酸钡,其中氢氧化镁、碳酸钙、碳酸钡会溶于稀盐酸,重新进入溶液,达不到除杂目的.若先加盐酸再过滤,将对提纯效果产生影响,其原因是在酸性条件下会有部分沉淀溶解,从而影响精盐的纯度.
故答案为:在酸性条件下会有部分沉淀溶解,从而影响精盐的纯度.
点评 本题考查在除杂的过程中,除杂试剂要注意添加顺序,除杂的一些基本反应离子方程式的书写,分离提纯实验操作中常用仪器玻璃棒的作用考查,第(1)小题较难.

练习册系列答案
相关题目
11.常温下,0.05mol•L-1Ba(OH)2溶液的pH为( )
| A. | 13 | B. | 1 | C. | 1.3 | D. | 12.7 |
8.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素的单质中熔点最高的可能是石墨(填名称).
(2)D的氢化物比G的氢化物稳定,其原因是D的非金属性比G的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”),用电子式表示该物质的形成过程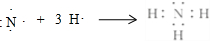 .
.
(4)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的C、F(填字母序号)元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2=2Na2CO3+O2
(5)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为N2,其电子式为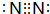 .
.
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)D的氢化物比G的氢化物稳定,其原因是D的非金属性比G的强的缘故.
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”),用电子式表示该物质的形成过程
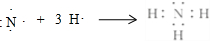 .
.(4)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的C、F(填字母序号)元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2=2Na2CO3+O2
(5)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为N2,其电子式为
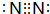 .
.
15.乙醛(CH3CHO)、乙酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含氢的质量分数为( )
| A. | $\frac{6A%}{7}$ | B. | $\frac{1-A%}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
5.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
9.能正确表示下列反应的离子方程式是( )
| A. | 过量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 用CH3COOH溶液溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
10.已知元素A~E表示元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)A在元素周期表中的位置为第二周期第ⅣA族,元素A的一种同位素可测定文物年代,这种同位素的符号是146C.比较B、D、E的离子半径的大小S2->O2->Na+(用离子符号表示).
(2)用电子式表示元素B形成的10e-的氢化物分子的形成过程 .
.
(3)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为 .
.
(4)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是离子化合物(填“共价化合物”或“离子化合物”),甲中的化学键类型为离子键、共价键.
(5)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(6)元素D的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式H2O2+H2S=S↓+2H2O.
| 元素 | 性质或结构信息 |
| A | 组成有机物的必须元素 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
(2)用电子式表示元素B形成的10e-的氢化物分子的形成过程
 .
.(3)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为
 .
.(4)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是离子化合物(填“共价化合物”或“离子化合物”),甲中的化学键类型为离子键、共价键.
(5)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(6)元素D的气态氢化物与过氧化氢溶液混合后有浅黄色固体生成,请写出发生的化学方程式H2O2+H2S=S↓+2H2O.
