题目内容
6.下列离子方程式书写正确的是( )| A. | 将Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| C. | 用锌粉还原AgCl浊液获得银:2AgCl+Zn═2Ag+Zn2++2Cl- | |
| D. | 向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液:Fe2++2OH-═Fe(OH)2↓ |
分析 A.三价铁具有氧化性能氧化碘离子;
B.氢氧化钠过量反应生成碳酸钙、碳酸钠和水;
C.二者反应生成氯化锌和银;
D.氢氧化钠过量,氨根离子、二价铁离子都发生反应;
解答 解;A.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2,故A错误;
B.向Ca(HCO3)2溶液中加入过量NaOH溶液,离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故B错误;
C.用锌粉还原AgCl浊液获得银,离子方程式:2AgCl+Zn═2Ag+Zn2++2Cl-,故C正确;
D.向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液,离子方程式:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH4+,故D错误;
故选:C.
点评 本题考查了离子方程式的书写原则和注意问题,侧重考查氧化还原反应、复分解反应的离子方程式书写,解题时注意不要漏写反应的离子,反应应遵循客观事实.

练习册系列答案
相关题目
17.下列各组物质中化学键的类型完全相同的是( )
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
1.下列物质中,属于非电解质的是( )
| A. | NaHCO3 | B. | CH3COOH | C. | C6H12O6 | D. | Na2CO3 |
11.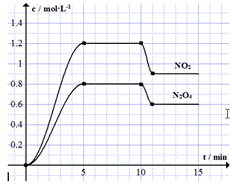 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
①2NO(g)+O2(g)?2NO2(g)△H<0
②2NO2(g)?N2O4(g)△H<0.
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T℃,10min时改变某反应条件,一段时间后再次平衡.下列说法正确的是( )
 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)△H<0
②2NO2(g)?N2O4(g)△H<0.
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T℃,10min时改变某反应条件,一段时间后再次平衡.下列说法正确的是( )
| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
2.1000mL某待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(所加试剂均过量):

(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:存在,K+离子最小浓度为0.1mol/L.
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol•L-1 |
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
19.下表是部分短周期元素的信息,用化学用语回答下列问题.
(1)元素A在周期表中的位置第二周期ⅣA族.B的某种核素中中子数比质子数多1,则表示该核素的原子符号为715N.
(2)写出钙与M原子个数比为1:2化合物的电子式 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
(3)M2-、D+、G2-离子半径大小顺序是S2->O2->Na+(用离子符号回答).
(4)由A、B、M及氢四种原子构成的分子A2H5BM2,既可以和盐酸反应又可以和氢氧化钠溶液反应,写出A2H5BC2的名称甘氨酸.
(5)某同学设计实验证明A、B、F的非金属性强弱关系.
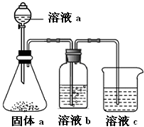
①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-.
(6)将0.5mol D2M2投入100mL 3mol/L ECl3溶液中,转移电子的物质的量为0.5mol.
(7)工业上冶炼E,以石墨为电极,阳极产生的混合气体的成分为O2、CO2(或CO).
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、-4 |
| 元素 | D | M | G | E |
| 性质 结构 信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 氢化物常温下呈液态,M的双原子阴离子有18个电子 | 原子核外的M层比L层少2个电子. | +3价阳离子的核外电子排布与氖原子相同. |
(2)写出钙与M原子个数比为1:2化合物的电子式
 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.(3)M2-、D+、G2-离子半径大小顺序是S2->O2->Na+(用离子符号回答).
(4)由A、B、M及氢四种原子构成的分子A2H5BM2,既可以和盐酸反应又可以和氢氧化钠溶液反应,写出A2H5BC2的名称甘氨酸.
(5)某同学设计实验证明A、B、F的非金属性强弱关系.

①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-.
(6)将0.5mol D2M2投入100mL 3mol/L ECl3溶液中,转移电子的物质的量为0.5mol.
(7)工业上冶炼E,以石墨为电极,阳极产生的混合气体的成分为O2、CO2(或CO).
20.利用分液漏斗可以分离的一组混合物是( )
| A. | 溴和四氯化碳 | B. | 乙醇和乙酸 | C. | 硝基苯和水 | D. | 溴苯和苯 |
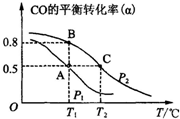 利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示: