题目内容
14.分子式为C16H16O2的某芳香族化合物A,能在酸性条件下水解生成B和C,B在一定条件下可氧化生成C.则A的结构式可能有( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
分析 分子式为C16H16O2的某芳香族化合物A,根据不饱和度为9,在酸性条件下水解生成B和C,则说明A应为酯,分子中含有2个苯环,1个酯基,一定条件下能转化成C,则B为醇,C为酸,B能被氧化为酸,B、C中都含有8个碳原子,都含有1个苯环,则取代基为-CH2OH和-CH3或-CH2CH2OH,含有2个取代基时在苯环上存在邻、间、对三种结构来解答;
解答 解:分子式为C16H16O2的某芳香族化合物A,根据不饱和度为9,在酸性条件下水解生成B和C,则说明A应为酯,分子中含有2个苯环,1个酯基,一定条件下能转化成C,则B为醇,C为酸,B能被氧化为酸,B、C中都含有8个碳原子,都含有1个苯环,则取代基为-CH2OH和-CH3或-CH2CH2OH,含有2个取代基时在苯环上存在邻、间、对三种结构,共4种结构,故选A.
点评 本题考题有机物的推断,题目难度不大,注意根据B转化为C的性质和取代基的确定与位置.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列中和反应中放出热量最多的是( )
| A. | 100 mL 0.3 mol/L 的HCl 和50 mL 0.3 mol/L 的NaOH相混合 | |
| B. | 80mL 0.3 mol/L 的HCl 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L 的H2SO4 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L 的H2SO4 和50 mL 0.6 mol/L 的NaOH溶液相混合 |
2.珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是( )
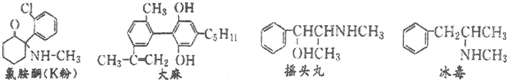

| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | K粉的化学式为C13H15ONCl | |
| C. | 摇头丸经过消去反应、加成反应可制取冰毒 | |
| D. | 1mol大麻与溴水反应最多消耗4molBr2 |
9.下列微粒半径的比较中,正确的是( )
| A. | r(Na+)>r(Na) | B. | r(Cl-)>r(Cl) | C. | r(Ca2+)>r(Cl-) | D. | r(Mg)>r(Na) |
19.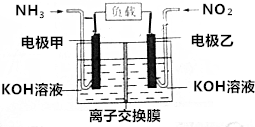 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )| A. | 电极乙为电池负极 | |
| B. | 离子交换膜为质子交换膜 | |
| C. | 负极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 28.0L(标准状况)NO2完全处理,转移5mol电子 |
6.下列离子方程式书写正确的是( )
| A. | 将Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| C. | 用锌粉还原AgCl浊液获得银:2AgCl+Zn═2Ag+Zn2++2Cl- | |
| D. | 向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液:Fe2++2OH-═Fe(OH)2↓ |
7.某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.为进一步研究有关因素对反应速率的影响,探究如下.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
实验①②是探究KIO3溶液的浓度对反应速率的影响,表中t1>t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率
逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成下表中内容.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率
逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |



