题目内容
16.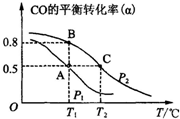 利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:(1)写出该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})^{2}}$.
(2)上述合成甲醇的反应为放热反应(填“放热”或“吸热”).
A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC.A、B两点对应的压强大小关系是PA小于PB(填“大于”、“小于”或“等于”).
(3)若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为H2SO4溶液,则该电池工作时负极的电极反应式为CH3OH(g)+H2O-6e-=CO2+6H+,理论上通过外电路的电子最多为30mol.
分析 (1)K等于生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算;
(2)化学平衡图象分析方法,平衡图象题主要注意三点一趋势,三点是:图象的起点、拐点、终点,一趋势是看曲线的变化趋势.当然要看好横、纵坐标的向量;
对于一个给定的化学反应,化学平衡常数的影响因素只有温度;
相同温度下,增大压强平衡右移,CO的转化率增大;
(3)依据原电池原理分析,燃料电池是燃料在负极失电子发生氧化反应,正极是氧气得到电子发生还原反应,依据电解质溶液时酸性溶液书写电极反应;
由图示可知,在平衡状态B时,CO转化率为0.5,可知生成甲醇的物质的量为5mol,根据电极反应式计算外电路通过电子.
解答 解:(1)反应的化学方程式为CO(g)+2H2(g)?CH3OH(g),平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})^{2}}$,故答案为:$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})^{2}}$;
(2)从图上可见,在P2时,随温度的升高CO的转化率越来越低,可见,升温时平衡向逆向移动,据勒夏特列原理,正反应放热.化学平衡常数只受温度的影响,该反应放热,温度越高平衡逆向移动,K值减小.相同温度下,增大压强平衡右移,CO的转化率增大,即CO转化率越大压强越大,
故答案为:放热; KA=KB>KC;小于;
(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH(g)+H2O-6e-=CO2+6H+.由图示可知,在平衡状态A时,CO转化率为0.5,可知生成甲醇的物质的量为5mol,根据电极反应式可知失去电子数为:5mol×6=30mol,
故答案为:CH3OH(g)+H2O-6e-=CO2+6H+;30.
点评 本题考查较综合,主要是平衡常数、化学平衡图象及平衡移动影响因素、原电池电极反应书写等,侧重分析能力、计算能力及知识迁移应用能力的考查,综合性较强,题目难度中等.

| A. | H2O2溶液与酸性KMnO4溶液反应:2MnO4-+3H2O2+6H+═2Mn2++6H2O+4O2↑ | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2 NO3-+8H++6I-═3I2+2NO↑+4H2O | |
| C. | 少量SO2通入碳酸钠溶液中:CO32-+SO2═CO2+S O32- | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
| A. | 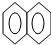 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$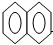 -NO2+H2O -NO2+H2O | |
| B. | CH3CH2CH2CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3 |
| A. | CaCl2 | B. | H2O2 | C. | Na2S | D. | NaOH |
| A. | 100 mL 0.3 mol/L 的HCl 和50 mL 0.3 mol/L 的NaOH相混合 | |
| B. | 80mL 0.3 mol/L 的HCl 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L 的H2SO4 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L 的H2SO4 和50 mL 0.6 mol/L 的NaOH溶液相混合 |
| A. | 将Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| C. | 用锌粉还原AgCl浊液获得银:2AgCl+Zn═2Ag+Zn2++2Cl- | |
| D. | 向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液:Fe2++2OH-═Fe(OH)2↓ |




 .
.