题目内容
11.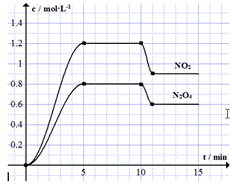 向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:
向容积固定为2L的密闭容器中充入9.6molNO和4.8molO2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)△H<0
②2NO2(g)?N2O4(g)△H<0.
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T℃,10min时改变某反应条件,一段时间后再次平衡.下列说法正确的是( )
| A. | 前5min反应的平均速率v(NO)=0.24mol•(L•min)-1 | |
| B. | T℃时反应①的化学平衡常数K=0.36 | |
| C. | 10min时改变反应条件可能是降低温度 | |
| D. | 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同 |
分析 A、根据化学反应速率v=$\frac{△c}{△t}$来计算化学反应速率;
B、先计算NO和O2消耗的浓度,然后得到平衡浓度,带入化学平衡常数公式进行解答;
C、根据温度对化学平衡移动的影响来判断反应的吸放热;
D、根据等效平衡的观点解决.
解答 解:A、反应①中消耗的c(NO)=1.2mol/L+0.8×2mol/L=2.8mol/L,前5min反应的平均速率v(NO2)=$\frac{△c}{△t}$=$\frac{2.8}{5}$=0.56mol•(L•min)-1,故v(NO)=0.56mol•(L•min)-1,故A错误;
B、反应①中消耗的c(NO)=2.8mol/L,消耗的c(O2)=$\frac{1}{2}$×2.8mol/L=1.4mol/L,因此达到平衡后,c(NO)=$\frac{9.6mol}{2L}$-2.8mol/L=2mol/L,c(O2)=$\frac{4.8mol}{2L}$-1.4mol/L=1mol/L,c(NO2)=1.2mol/L,则反应①的化学平衡常数K=$\frac{1.{2}^{2}}{{2}^{2}×1}$=0.36,故B正确;
C,在该题中,反应为放热,降低温度后,平衡正向移动,四氧化二氮的浓度增加,故C错误;
D、若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,与之前的充入量等效,故NO2的物质的量浓度与图中5~10min的相同,故D错误.
故选B.
点评 本题考查学生化学反应速率和化学平衡的有关计算知识,属于综合知识的考查,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.有机化学中取代反应范畴很广,下列4个反应中,属于取代反应范畴的是( )
| A. | 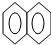 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$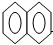 -NO2+H2O -NO2+H2O | |
| B. | CH3CH2CH2CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | (CH3)2CHCH=CH2+HI→(CH3)2CHCHICH3 |
2.珍爱生命,远离毒品.以下是四种毒品的结构简式,下列有关说法正确的是( )


| A. | 四种毒品中都含有苯环,都属于芳香烃 | |
| B. | K粉的化学式为C13H15ONCl | |
| C. | 摇头丸经过消去反应、加成反应可制取冰毒 | |
| D. | 1mol大麻与溴水反应最多消耗4molBr2 |
19.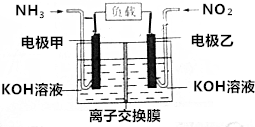 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )| A. | 电极乙为电池负极 | |
| B. | 离子交换膜为质子交换膜 | |
| C. | 负极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 28.0L(标准状况)NO2完全处理,转移5mol电子 |
6.下列离子方程式书写正确的是( )
| A. | 将Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| C. | 用锌粉还原AgCl浊液获得银:2AgCl+Zn═2Ag+Zn2++2Cl- | |
| D. | 向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液:Fe2++2OH-═Fe(OH)2↓ |
16.某溶液中的阳离子有四种,分别是NH4+、Mg2+、Fe2+和Al3+,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的金属离子是( )
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | NH4+ |
7.某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.为进一步研究有关因素对反应速率的影响,探究如下.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
实验①②是探究KIO3溶液的浓度对反应速率的影响,表中t1>t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率
逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成下表中内容.
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率
逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |
4.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
①预测元素周期表中,X值最小的元素位置和名称:第六周期第IA族,铯(放射性元素除外).
②根据表中的所给数据分析,同周期内的不同元素X的值变化的规律是随着原子序数的增大而增大
通过分析X值变化规律,确定P、Mg 的X值范围:1.7<X(P)<2.3,1.5<X(Mg)<0.9.
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3、Al2O3中形成的化学键的类型分别为共价键、离子键(填离子键或共价键)
④根据所学分子的立体构型和杂化方式来填写下列表格
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.5 | 1.7 | 2.3 | 3.0 | 0.8 |
①预测元素周期表中,X值最小的元素位置和名称:第六周期第IA族,铯(放射性元素除外).
②根据表中的所给数据分析,同周期内的不同元素X的值变化的规律是随着原子序数的增大而增大
通过分析X值变化规律,确定P、Mg 的X值范围:1.7<X(P)<2.3,1.5<X(Mg)<0.9.
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlCl3、Al2O3中形成的化学键的类型分别为共价键、离子键(填离子键或共价键)
④根据所学分子的立体构型和杂化方式来填写下列表格
| 微粒 | BeCl2 | H2S | NH3 | CO32- | BF3 |
| 中心原子杂化方式 | |||||
| 微粒的空间构型 |
5.下列试剂保存的方法中不是从氧化还原反应角度考虑的是( )
| A. | 钠保存在石蜡油或煤油中 | |
| B. | 氯水保存在棕色的试剂瓶中 | |
| C. | 保存FeCl2溶液需加入少量铁粉 | |
| D. | 盛装NaOH溶液的试剂瓶不能用玻璃塞 |