题目内容
2.1000mL某待测液中除含有0.2mol•L-1的Na+外,还可能含有下列离子中的一种或多种:| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |

(1)写出生成白色沉淀B的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O.
(2)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol•L-1 |
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是CO32-、HCO3-、SO32-.
分析 (1)待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(2)若无色气体D是单一气体,则D为CO2,E为CaCO3,溶液中含有CO32-,白色沉淀D只能为BaSO4,溶液中一定没有SO32-,一定含有SO42-,计算B(碳酸钡)、E(碳酸钙)、硫酸钡的物质的量,根据离子守恒计算各离子的浓度;
根据电荷守恒判断是否含有钾离子,若溶液含有K+,当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒计算;
(3)溶液中一定含有CO32-、HCO3-,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-,若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-.
解答 解:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO3-、Ba2+、OH-反应生成,反应离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,
故答案为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
(2)①由上述分析可知,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-.
若无色气体D是单一气体,则D为CO2,E为CaCO3,溶液中含有CO32-,白色沉淀D只能为BaSO4,溶液中一定没有SO32-,一定含有SO42-,
B(碳酸钡)的物质的量=$\frac{19.7g}{197g/mol}$=0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=$\frac{0.1mol}{1L}$=0.1mol/L,
E(碳酸钙)的物质的量=$\frac{10g}{100g/mol}$=0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=$\frac{0.1mol}{1L}$=0.1mol/L,
D(硫酸钡)的物质的量=$\frac{11.65g}{233g/mol}$=0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=$\frac{0.05mol}{1L}$=0.05mol/L,
故答案为:
| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol•L-1 | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |
故答案为:存在;K+离子最小浓度为0.1mol/L;
(3)①由上述分析可知,溶液中一定含有CO32-、HCO3-,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-.
若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,待测液中一定含有的阴离子是CO32-、HCO3-、SO32-,
故答案为:CO32-、HCO3-、SO32-.
点评 本题考查了离子的推断、检验,熟悉物质的性质是解本题关键,根据实验过程中反应现象、离子共存条件来确定溶液中存在的离子,注意根据溶液中电荷守恒确定钾离子是否存在,同时考查学生综合运用知识解决问题的能力,题目难度较大.

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | CaCl2 | B. | H2O2 | C. | Na2S | D. | NaOH |
| A. | r(Na+)>r(Na) | B. | r(Cl-)>r(Cl) | C. | r(Ca2+)>r(Cl-) | D. | r(Mg)>r(Na) |
| A. | 将Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| C. | 用锌粉还原AgCl浊液获得银:2AgCl+Zn═2Ag+Zn2++2Cl- | |
| D. | 向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液:Fe2++2OH-═Fe(OH)2↓ |
| A. | “玉兔”月球车上的太阳能电池的材料是硅酸盐 | |
| B. | 利用二氧化碳制造全降解塑料,可以消除温室效应 | |
| C. | 实验室镁着火时,可使用泡沫灭火器灭火 | |
| D. | 可使用氢氧化钠溶液鉴别大豆油与矿物油 |
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定.已知第一步反应的离子方程式为IO3-+3HSO3-═3SO42-+I-+3H+,则第二步反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O.
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下.
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
实验①③是探究温度对反应速率的影响,表中a=10.0,b=4.0.、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率
逐渐增大.该小组对其原因提出如下假设,请你完成假设二.
假设一:生成的SO42-对反应起催化作用;
假设二:生成的I-或H+对反应起催化作用;
…
(4)请你设计实验验证上述假设一,完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |
| 试管编号 | 加3%Na2S2O3溶液/ml | 加H2O/ml | 加H2SO4(1:5)/滴 | 出现浑浊所用时间/s |
| ① | 3 | 3 | 5 | a |
| ② | 4 | 2 | 5 | b |
| ③ | 5 | 1 | 5 | c |
(2)实验结论:对于一个化学反应,在其他条件不变时,反应物的浓度越大,化学反应速率越大
(3)写出反应的化学方程式:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O.
| A. | 乙烷和氯气取代 | B. | 乙烯和氢气加成后,在用氯气取代 | ||
| C. | 乙烯和氯化氢加成 | D. | 乙烯和氯气加成 |
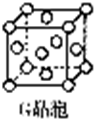 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题: