题目内容
20.利用分液漏斗可以分离的一组混合物是( )| A. | 溴和四氯化碳 | B. | 乙醇和乙酸 | C. | 硝基苯和水 | D. | 溴苯和苯 |
分析 分液漏斗可以将互不相溶的两层液体分开.
解答 解:A.溴和四氯化碳是互溶的,不能用分液漏斗分离,故A错误;
B.乙醇和乙酸是互溶的,不能用分液漏斗分离,故B错误;
C.硝基苯和水互不相溶,分层,可以用分液漏斗分离,故C正确;
D.溴苯和苯是互溶的,不能用分液漏斗分离,故D错误.
故选C.
点评 本题考查物质分离方法中的分液法,注意分液漏斗能分离的物质必须是互不相溶的液体,难度不大.

练习册系列答案
相关题目
6.下列离子方程式书写正确的是( )
| A. | 将Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| C. | 用锌粉还原AgCl浊液获得银:2AgCl+Zn═2Ag+Zn2++2Cl- | |
| D. | 向(NH4)2Fe(SO4)2溶液中滴入过量NaOH溶液:Fe2++2OH-═Fe(OH)2↓ |
11.制取较纯的一氯乙烷,最佳的方案是( )
| A. | 乙烷和氯气取代 | B. | 乙烯和氢气加成后,在用氯气取代 | ||
| C. | 乙烯和氯化氢加成 | D. | 乙烯和氯气加成 |
15.元素周期表的一部分,回答下列问题(用元素符号填写):
(1)分别写出①、③两种元素形成的高价态化合物的结构式O=C=O
(2)写出⑨的原子结构示意图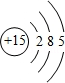 .
.
(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式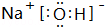 ,其溶于水时破坏的作用力为离子键
,其溶于水时破坏的作用力为离子键
(4)这些元素的最高价氧化物的对应水化物中酸性最强HClO4;形成的两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到⑪的元素中,原子半径最小Cl.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出⑨的原子结构示意图
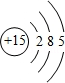 .
.(3)在这些元素中,最活泼的金属元素的最高价氧化物对应水化物的电子式
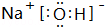 ,其溶于水时破坏的作用力为离子键
,其溶于水时破坏的作用力为离子键(4)这些元素的最高价氧化物的对应水化物中酸性最强HClO4;形成的两性氢氧化物的化学式是Al(OH)3;上述两者反应的离子方程式Al(OH)3+3H+═Al3++3H2O
(5)从⑤到⑪的元素中,原子半径最小Cl.
5.下列试剂保存的方法中不是从氧化还原反应角度考虑的是( )
| A. | 钠保存在石蜡油或煤油中 | |
| B. | 氯水保存在棕色的试剂瓶中 | |
| C. | 保存FeCl2溶液需加入少量铁粉 | |
| D. | 盛装NaOH溶液的试剂瓶不能用玻璃塞 |
9.砹(At)与F、Cl、Br、I同主族,推测砹AA或砹的化合物不可能具有的性质是( )
| A. | 砹单质是有色固体 | |
| B. | 非金属性:At>I | |
| C. | HAt的稳定性比HI的弱 | |
| D. | I2可以从At的可溶性盐溶液中置换出来At2 |
10.同周期的X、Y、Z三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3ZO4<H2YO4<HXO4,则下列判断正确的是( )
| A. | 原子半径 X>Y>Z | |
| B. | 非金属性 X>Y>Z | |
| C. | X、Y、Z的单质与氢气化合能力由弱到强 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
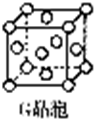 现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题:
现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其它五种元素都是短周期元素.X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分.取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体.G2E是红色固体.请回答下列问题: