题目内容
3.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl═SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100℃反应制得纯硅.
已知SiHCl3能与H2O强烈反应,在空气中易自燃.
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点-33℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为蒸馏.
(3)用SiHCl3与过量H2反应制备纯硅的装置如图(热源及夹持装置略去)
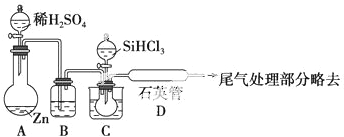
①装置B中的试剂是浓硫酸.装置C中的烧瓶需要加热,其目的是使SiHCl3气化.
②反应一段时间后,装置D中观察到的现象是石英管的内壁附有灰黑色晶体,装置D不能采用普通玻璃管的原因是SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化.
装置D中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及先通一段时间H2,将装置中的空气排尽.
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)bd.
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液.
分析 (1)高温下,碳和二氧化硅反应生成硅和一氧化碳;
(2)利用沸点的不同提纯SiHCl3,可用蒸馏的方法;
(3)①生成的氢气含有水蒸气,用浓H2SO4干燥;加热促使SiHCl3气化;
②SiHCl3和氢气反应有硅单质生成,根据硅的颜色判断D装置中的颜色变化;SiHCl3和H2反应生成硅和氯化氢;
③氢气是可燃性气体,易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽;
④取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
解答 解:(1)高温下,碳做还原剂时,生成CO,即2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(2)利用沸点的不同提纯SiHCl3,可用蒸馏的方法,故答案为:蒸馏;
(3)①锌和稀硫酸的反应是放热反应,所以生成的氢气含有水蒸气,为干燥氢气,一般选用浓H2SO4干燥;气体的反应速率较大,所以加热的目的是使SiHCl3气化,
故答案为:浓硫酸;使SiHCl3气化;
②高温下,SiHCl3和氢气反应生成硅单质,硅单质是灰黑色固体,所以D装置中的现象是:石英管的内壁附有灰黑色晶体,反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,
SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化,
故答案为:石英管的内壁附有灰黑色晶体;SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅,温度太高,普通玻璃管易熔化;SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
③氢气是可燃性气体,当氢气的量达到一定时易产生爆炸,为防止安全事故的发生,所以先通一段时间H2,将装置中的空气排尽,
故答案为:先通一段时间H2,将装置中的空气排尽;
④铁能和酸反应生成亚铁离子,亚铁离子有还原性,亚铁离子能被氯水氧化生成铁离子,铁离子遇硫氰化钾溶液变红色,所以可以用氯水和硫氰化钾溶液检验铁的存在,故选bd.
点评 本题考查了实验方案设计的有关知识,铁离子和亚铁离子的检验在高考题中出现,这种类型的题是高考的热点,是学习的重点,会根据实验目的和物质的性质选取实验装置和实验药品,然后进行相应的实验.

 阅读快车系列答案
阅读快车系列答案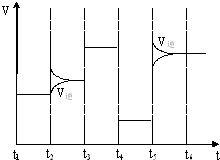 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(2)上述反应T1℃时的平衡常数K1=4.
(3)上述反应T1℃时达到平衡后,再通入0.1mol的NO的气体,则达到新平衡时NO的转化率为80%.
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,
且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断温度的高低T1<T2,该反应△H<0.
| A. | 钱恩 | B. | 屠呦呦 | C. | 弗莱明 | D. | 莫言 |
①向饱和Na2CO3溶液中通入过量CO2
②向Fe(OH)3胶体中逐滴滴入过量的H2SO4
③向Ba(NO3)2溶液中通入过量SO2
④向石灰水中通入过量CO2
⑤向Na2SiO3溶液中滴入过量的盐酸.
| A. | ①③⑤ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③ |
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电力平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | NaCN溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2=2HCN+CO${\;}_{3}^{2-}$ | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的甲酸溶液和氢氰酸溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
 砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:
砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题: 现.
现.