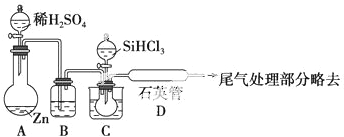
题目内容
15.剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒依然的HCN气体,同时HCN又能与水互溶,造成水污染.已知部分弱酸的电力平衡常数如表:| 弱酸 | HCOOH | HCN | H2CO3 |
| 电力平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | NaCN溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2=2HCN+CO${\;}_{3}^{2-}$ | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的甲酸溶液和氢氰酸溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
分析 弱酸的电离平衡常数越大,其酸性越强,依据电离常数大小判断酸性强弱,HCOOH>H2CO3>HCN>HCO3-,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:根据电离平衡常数知,酸性强弱顺序为:HCOOH>H2CO3>HCN>HCO3-,
A.氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2=HCN+HCO3-反应,故A错误;
B.处理含CN-废水时,如用NaOH溶液调节pH至9,溶液中只有小部分CN-水解,此时c(CN-)>c(HCN),故B错误;
C.等pH的HCOOH和HCN溶液,甲酸的物质的量浓度小于氢氰酸,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数大,故D错误;
故选C.
点评 本题考查了离子方程式的书写,侧重考查强酸制备弱酸的原理,依据图中电离常数判断酸性强弱是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是( )
| 物质 | 杂质 | 除杂质应选用的试剂和操作方法 | |
| A | CO2 | CO | 通入O2,点燃 |
| B | 乙醇 | 汽油 | 加入CCl4萃取、分液 |
| C | Cu(NO3)2溶液 | AgNO3溶液 | 加入过量的铜粉,过滤 |
| D | KNO3溶液 | KOH溶液 | 加入适量的CuSO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
10.下列物质与其用途完全符合的有多少条( )
①干冰-人工降雨
②Na2CO3-制玻璃
③Fe2O3-红色油漆或涂料
④Al2O3-耐火材料
⑤NaClO-消毒剂
⑥NaCl-制纯碱;
⑦KAl (SO4 )2-消毒、净水.
①干冰-人工降雨
②Na2CO3-制玻璃
③Fe2O3-红色油漆或涂料
④Al2O3-耐火材料
⑤NaClO-消毒剂
⑥NaCl-制纯碱;
⑦KAl (SO4 )2-消毒、净水.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
20.乙烯是农业上常用的一种催熟剂,能够促进果实的成熟,下列关于有关说不正确的是( )
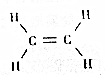
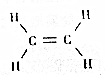
| A. | 乙烯是由碳、氢两种元素组成的 | |
| B. | 乙烯中碳元素的质量分数为85.7% | |
| C. | 乙烯是一种有机高分子化合物 | |
| D. | 乙烯中碳、氢两种元素的原子个数比是1:2 |
7.下列化学实验能达到目的是( )
| A. | 用饱和NaHCO3溶液除CO2中的氯化氢气体 | |
| B. | SO2与乙烯的混合气体依次通入酸性高锰酸钾溶液、浓硫酸洗气后可得到纯净的SO2 | |
| C. | 用酒精萃取碘水中的碘单质 | |
| D. | 用CaO干燥Cl2 |
7.下列物质中属于高分子化合物的是( )
①油脂②蔗糖③羊毛④葡萄糖⑤纤维素⑥谷氨酸⑦胃蛋白酶.
①油脂②蔗糖③羊毛④葡萄糖⑤纤维素⑥谷氨酸⑦胃蛋白酶.
| A. | ①⑤⑦ | B. | ②④⑥ | C. | ③⑤⑦ | D. | ④⑤⑥ |