题目内容
下列有关铜锌原电池的叙述正确的是( )


| A、盐桥中的Cl-移向CuSO4溶液 |
| B、电池总反应为Zn+Cu2+=Zn2++Cu |
| C、在外电路中,电子从正极流向负极 |
| D、取下盐桥,原电池仍可工作 |
考点:原电池和电解池的工作原理
专题:
分析:铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,阳离子移向正极,阴离子移向负极,以此解答该题.
解答:
解:A、盐桥中的Cl-移向负极ZnSO4溶液,故A错误;
B、铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,故B正确;
C、原电池工作时,电子从电池负极经外电路流向正极,故C错误;
D、取下盐桥,不能形成闭合回路,原电池不能工作,故D错误;
故选B.
B、铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,故B正确;
C、原电池工作时,电子从电池负极经外电路流向正极,故C错误;
D、取下盐桥,不能形成闭合回路,原电池不能工作,故D错误;
故选B.
点评:本题考查原电池的工作原理,注意把握工作原理以及电极方程式的书写,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不跟NaOH溶液反应的衍生物种类有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A、25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
| B、将0.1 mol?L-1的醋酸加水不断稀释,所有离子浓度均减小 |
| C、少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| D、少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO |
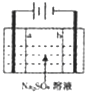 近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )
近来人们开发了通过电解同时生产NaOH和H2SO4的化学工艺,现在用离子交换膜(a、b)和石墨作电极的电解池进行生产模根,下列主产法中不正确的是( )| A、阴极反应式4OH--4e-=2H2O+O2↑ |
| B、阴极得到NaOH,阳极得到H2SO4 |
| C、每生产1molH2SO4,同时得到2mol NaOH |
| D、此反应实质就是电解水 |
下列现象中,能用范德华力解释的是( )
| A、氮气的化学性质稳定 |
| B、通常状况下,溴呈液态,碘呈固态 |
| C、水的沸点比硫化氢高 |
| D、锂的熔点比钠高 |
 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
与CO分子含有相同电子数的分子是( )
| A、HCl |
| B、N2 |
| C、H2O |
| D、CO2 |