题目内容
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A、25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
| B、将0.1 mol?L-1的醋酸加水不断稀释,所有离子浓度均减小 |
| C、少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| D、少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:根据表中电离平衡常数可知,酸性大小:亚硫酸>醋酸>碳酸>亚硫酸氢根离子>次氯酸>碳酸氢根离子,
A.弱酸的钠盐溶液中,酸越弱,其水解程度越大,则钠盐溶液的碱性越强,据此进行判断;
B.醋酸为酸,加入水稀释的过程中氢离子浓度减小;
C.由于反应生成的次氯酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
D.次氯酸的酸性大于碳酸氢根离子,所以反应生成次氯酸和碳酸氢根离子.
A.弱酸的钠盐溶液中,酸越弱,其水解程度越大,则钠盐溶液的碱性越强,据此进行判断;
B.醋酸为酸,加入水稀释的过程中氢离子浓度减小;
C.由于反应生成的次氯酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
D.次氯酸的酸性大于碳酸氢根离子,所以反应生成次氯酸和碳酸氢根离子.
解答:
解:根据表中数据可知,酸性大小:亚硫酸>醋酸>碳酸>亚硫酸氢根离子>次氯酸>碳酸氢根离子,
A.相同物质的量浓度的含有弱酸根离子的钠盐溶液,对应酸的酸性越弱则酸根离子水解程度越大,溶液中氢氧根离子浓度越大,pH越大,水解程度大小顺序是:SO32-<CH3COO-<ClO-<CO32-,所以相同温度时,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,碱性最强的是Na2CO3,故A正确;
B.醋酸溶液中加一定量水,醋酸的电离程度增大,但是溶液中氢离子浓度减小,由于Kw不变,所以氢氧根离子的浓度增大,故B错误;
C.少量的SO2通入Ca(ClO)2溶液中,反应生成的次氯酸能够氧化亚硫酸根离子,正确的离子方程式为:Ca2++2SO2+2H2O+2ClO-→CaSO4↓+SO42-+4H++2Cl-,故C错误;
D.CO2通入NaClO溶液中,反应生成次氯酸和碳酸氢根离子,反应的离子方程式为:CO2+H2O+ClO-→HCO3-+HClO,故D错误;
故选A.
A.相同物质的量浓度的含有弱酸根离子的钠盐溶液,对应酸的酸性越弱则酸根离子水解程度越大,溶液中氢氧根离子浓度越大,pH越大,水解程度大小顺序是:SO32-<CH3COO-<ClO-<CO32-,所以相同温度时,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,碱性最强的是Na2CO3,故A正确;
B.醋酸溶液中加一定量水,醋酸的电离程度增大,但是溶液中氢离子浓度减小,由于Kw不变,所以氢氧根离子的浓度增大,故B错误;
C.少量的SO2通入Ca(ClO)2溶液中,反应生成的次氯酸能够氧化亚硫酸根离子,正确的离子方程式为:Ca2++2SO2+2H2O+2ClO-→CaSO4↓+SO42-+4H++2Cl-,故C错误;
D.CO2通入NaClO溶液中,反应生成次氯酸和碳酸氢根离子,反应的离子方程式为:CO2+H2O+ClO-→HCO3-+HClO,故D错误;
故选A.
点评:本题考查了弱电解质的电离平衡、离子方程式的书写,题目难度中等,注意掌握弱电解质的电离平衡及其影响因素,能够正确书写离子方程式,选项B为易错点,注意次氯酸的强氧化性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
兴奋剂是体育比赛中禁用的药物,有一种兴奋剂的结构如图.关于它的说法中正确的是( )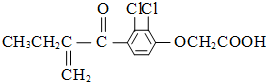

| A、该有机物能发生银镜反应 |
| B、分子中有4个碳碳双键 |
| C、既能发生还原反应,又能发生氧化反应 |
| D、1 mol 该物质最多跟6 mol氢气发生反应 |
俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥.下列不属于其中的反应的是( )
A、N2+O2
| |||
| B、2NO+O2→2NO2 | |||
| C、3NO2+H2O→2HNO3+NO | |||
D、4NH3+5O2
|
某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )

| A、实验①、③反应制得的物质均为纯净物 |
| B、实验②、③均未发生氧化还原反应 |
| C、实验②、③均为放热反应 |
| D、实验①、②所涉及的物质均为电解质 |
利用电解原理,在铁皮表面镀一层锌的有关叙述正确的是( )
| A、铁为负极,锌为正极 |
| B、铁为阳极,锌为阴极 |
| C、用可溶性铁盐作电解液 |
| D、锌元素既被氧化又被还原 |
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
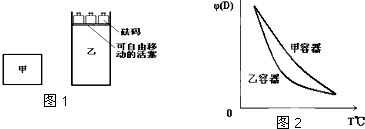

| A、甲容器中的反应先达到化学平衡状态 |
| B、两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C、两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D、在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |
下列有关铜锌原电池的叙述正确的是( )
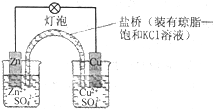

| A、盐桥中的Cl-移向CuSO4溶液 |
| B、电池总反应为Zn+Cu2+=Zn2++Cu |
| C、在外电路中,电子从正极流向负极 |
| D、取下盐桥,原电池仍可工作 |
下列物质中,碱性最强的是( )
| A、Mg(OH)2 |
| B、NaOH |
| C、KOH |
| D、LiOH |
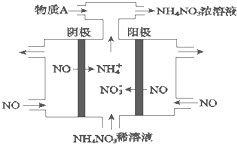 (1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为:
(1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为: