题目内容
工业上,通过如下转化可制得KClO3晶体:NaCl溶液
NaClO3溶液
KCl3晶体
①配平中反应的总化学方程式,并标出电子转移的方向和数目: NaCl+ H2O NaClO3+
②反应过程能析出KClO3晶体而无其它晶体析出的原因是 .
| 80℃,通电 |
| Ⅰ |
| 室温,KCl |
| Ⅱ |
①配平中反应的总化学方程式,并标出电子转移的方向和数目:
②反应过程能析出KClO3晶体而无其它晶体析出的原因是
考点:氧化还原反应方程式的配平,不同晶体的结构微粒及微粒间作用力的区别
专题:
分析:(1)电解氯化钠溶液,阳极上氯离子失去电子生成氯酸根离子,发生氧化反应,阴极氢离子得到电子发生还原反应生成氢气,依据化合价升级数相同配平方程式;
(2)相同温度下,溶解度小的物质先析出.
(2)相同温度下,溶解度小的物质先析出.
解答:
解:(1)电解氯化钠溶液,阳极上氯离子失去电子生成氯酸根离子,发生氧化反应,阴极氢离子得到电子发生还原反应生成氢气,依据化合价升级数相同配平方程式:NaCl+3H2O=NaClO3+3H2↑;
反应中,氯离子失去6e-生成氯酸根离子,电子转移的方向和数目为: ;
;
故答案为: ;
;
(2)NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;
故答案为:室温下,氯酸钾在水中的溶解度明显小于其它晶体.
反应中,氯离子失去6e-生成氯酸根离子,电子转移的方向和数目为:
 ;
;故答案为:
 ;
;(2)NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;
故答案为:室温下,氯酸钾在水中的溶解度明显小于其它晶体.
点评:本题考查了电解池、氧化还原反应方程式书写,明确电解池工作原理、准确判断电极放电物质是解题关键,注意氧化还原方程式中化合价升级数相等.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
俗话说“雷雨发庄稼”这是因为雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥.下列不属于其中的反应的是( )
A、N2+O2
| |||
| B、2NO+O2→2NO2 | |||
| C、3NO2+H2O→2HNO3+NO | |||
D、4NH3+5O2
|
下列有关铜锌原电池的叙述正确的是( )
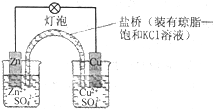

| A、盐桥中的Cl-移向CuSO4溶液 |
| B、电池总反应为Zn+Cu2+=Zn2++Cu |
| C、在外电路中,电子从正极流向负极 |
| D、取下盐桥,原电池仍可工作 |
下列物质中,碱性最强的是( )
| A、Mg(OH)2 |
| B、NaOH |
| C、KOH |
| D、LiOH |
下列物质中,含有的分子数目最少的是( )
| A、0.5molCO2 |
| B、标准状况下11.2L氨气 |
| C、8 g水 |
| D、6.02×1023个氯分子 |
设阿伏加德罗常数(NA)的数值为nA,下列说法中正确的是( )
| A、1 mol Cl2与足量NaOH反应,转移的电子数为2nA |
| B、1 mo1Na被完全氧化生成Na2O2,失去的电子数为2nA |
| C、常温常压下,22.4LSO2气体中含有的原子数小于3nA |
| D、0.1 mol/LNaOH溶液中含有Na+的数目为0.1 nA |
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中不正确的是( )
| A、酸式滴定管用蒸馏水洗净后,必须用已知浓度的盐酸润洗 |
| B、锥形瓶用蒸馏水洗净后,用NaOH溶液润洗后再加入待测液 |
| C、滴定时,必须逐出滴定管下口的气泡 |
| D、读数时,视线与滴定管内液体的凹液面最低处保持水平 |
 (1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为:
(1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为: