题目内容
与CO分子含有相同电子数的分子是( )
| A、HCl |
| B、N2 |
| C、H2O |
| D、CO2 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据原子序数判断原子的电子数目,O原子的电子数为8,C原子的电子数为6,所以CO含有14个电子,据此分析比较;
A.HCl中H原子的电子数为1,Cl原子的电子数为17,HCl分子中含有的电子数目为18;
B.N2中N原子的电子数为7,N2分子中含有的电子数目为14;
C.H2O中O原子的电子数为8,H原子的电子数为1,H2O分子中含有的电子数目为10;
D.CO2中C原子的电子数为6,O原子的电子数为8,CO2分子中含有的电子数目为22.
A.HCl中H原子的电子数为1,Cl原子的电子数为17,HCl分子中含有的电子数目为18;
B.N2中N原子的电子数为7,N2分子中含有的电子数目为14;
C.H2O中O原子的电子数为8,H原子的电子数为1,H2O分子中含有的电子数目为10;
D.CO2中C原子的电子数为6,O原子的电子数为8,CO2分子中含有的电子数目为22.
解答:
解:A.HCl中H原子的电子数为1,Cl原子的电子数为17,HCl分子中含有的电子数目为18,故A错误;
B.N2中N原子的电子数为7,N2分子中含有的电子数目为14,故B正确;
C.H2O中O原子的电子数为8,H原子的电子数为1,H2O分子中含有的电子数目为10,故C错误;
D.CO2中C原子的电子数为6,O原子的电子数为8,CO2分子中含有的电子数目为22,故D错误.
故选B.
B.N2中N原子的电子数为7,N2分子中含有的电子数目为14,故B正确;
C.H2O中O原子的电子数为8,H原子的电子数为1,H2O分子中含有的电子数目为10,故C错误;
D.CO2中C原子的电子数为6,O原子的电子数为8,CO2分子中含有的电子数目为22,故D错误.
故选B.
点评:本题考查原子构成,难度不大,注意根据质子数=核外电子数=原子序数解题.

练习册系列答案
相关题目
下列有关铜锌原电池的叙述正确的是( )
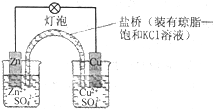

| A、盐桥中的Cl-移向CuSO4溶液 |
| B、电池总反应为Zn+Cu2+=Zn2++Cu |
| C、在外电路中,电子从正极流向负极 |
| D、取下盐桥,原电池仍可工作 |
设阿伏加德罗常数(NA)的数值为nA,下列说法中正确的是( )
| A、1 mol Cl2与足量NaOH反应,转移的电子数为2nA |
| B、1 mo1Na被完全氧化生成Na2O2,失去的电子数为2nA |
| C、常温常压下,22.4LSO2气体中含有的原子数小于3nA |
| D、0.1 mol/LNaOH溶液中含有Na+的数目为0.1 nA |
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中不正确的是( )
| A、酸式滴定管用蒸馏水洗净后,必须用已知浓度的盐酸润洗 |
| B、锥形瓶用蒸馏水洗净后,用NaOH溶液润洗后再加入待测液 |
| C、滴定时,必须逐出滴定管下口的气泡 |
| D、读数时,视线与滴定管内液体的凹液面最低处保持水平 |
下列说法中正确的是( )
| A、钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出 |
| B、工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+ |
| C、水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3 |
| D、珊瑚虫从周围海水中获取Ca2+和HCO3-,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚 |
 (1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为:
(1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为: