题目内容
14.氢键是介于范德华力和化学键之间的一种作用力,广泛存在于许多物质中.氢键的通式可表示为X-H…Y,其中X、Y均是非金属性较强、半径较小的原子,如F、O、N等;X、Y可以是同种原子也可以是不同种原子.(1)用氢键的通式分别表示:冰中H2O分子间的氢键O-H…O,氨水中H2O分子与NH3分子之间的氢键O-H…N,N-H…O.
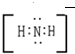
(2)已知水中2个水分子之间可以发生微弱的自偶电离,电离方程式为:2H2O?H3O++OH-.实验测得在液氨中2个NH3分子之间也可以微弱地电离生成含有相同电子数的离子,其电离方程式是:NH3+NH3?NH4++NH2-,写出这两种离子的电子式
 、
、 .
.
分析 (1)冰中一个水分子的O原子与另一个水分子中的H原子形成氢键;氨水中H2O中O原子与NH3分子中的H原子形成氢键,H2O中H原子与NH3分子中的N原子也形成氢键;
(2)根据水的电离方程式书写液氨的自偶电离方程式;多原子构成的阴离子和多原子构成的阳离子,电子式要加中括号和电荷.
解答 解:(1)冰中一个水分子的O原子与另一个水分子中的H原子形成氢键,即表示为O-H…O;氨水中H2O中O原子与NH3分子中的H原子形成氢键,即N-H…O,H2O中H原子与NH3分子中的N原子也形成氢键,即O-H…N;
故答案为:O-H…N;O-H…N,N-H…O;
(2)水电离生成H3O+和OH-叫做水的自偶电离.同水一样,液氨也有自偶电离,其自偶电离的方程式为:NH3+NH3?NH4++NH2-;NH4+是多原子构成的阳离子,电子式要加中括号和电荷,其电子式为: ;NH2-为多原子构成的阴离子,电子式要加中括号和电荷,其电子式为:
;NH2-为多原子构成的阴离子,电子式要加中括号和电荷,其电子式为: .
.
故答案为:NH3+NH3?NH4++NH2-; ;
; .
.
点评 本题考查了氢键、弱电解质的电离、电子式的书写,题目难度不大,注意把握题目中所给的信息、以及电子式的书写方法,侧重于考查学生的分析能力.

练习册系列答案
相关题目
4.以下有关物质结构的描述正确的是( )
| A. | 甲苯分子中的所有原子可能共平面 | B. |  分子中的所有原子可能共平面 分子中的所有原子可能共平面 | ||
| C. | 乙烷分子中的所有原子可能共平面 | D. | 二氯甲烷分子为正四面体结构 |
9.下列化学用语表示正确的是( )
| A. | Mg2+的结构示意图: | |
| B. | 乙酸的化学式:CH3CH2OH | |
| C. | 硫酸钾的电离方程式:K2SO4═${K}_{2}^{+}$+${SO}_{4}^{2-}$ | |
| D. | N2的结构式:N≡N |
19.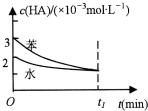 常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
 常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )| A. | HA在水中的电离速率大于其在苯中的双聚速率 | |
| B. | t1时刻在水中和苯中c(A-)相同 | |
| C. | 向上述的混合体系中加入少量水和苯的混合物,则两平衡均正移,c(HA)均减小 | |
| D. | 用10mL 0.05mol•L-1的NaOH溶液可恰好中和混合体系中的HA |
6.下列物质中,能够导电的电解质是( )
| A. | Cu丝 | B. | 熔融的MgCl2 | C. | 酒精 | D. | 蔗糖 |
7.下列各组内物质不论以任何比例混合,只要当混合物的质量一定时,混合物完全燃烧后生成的二氧化碳的量不变的是( )
| A. | 乙炔和苯 | B. | 一氧化碳和氢气 | C. | 乙炔和乙烯 | D. | 苯和乙烯 |
 ,
, ,稳定性较好.
,稳定性较好. 对甲基苯酚与溴水反应
对甲基苯酚与溴水反应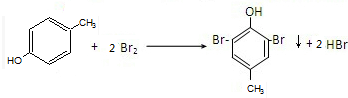
 环已二烯与氯气1,4加成
环已二烯与氯气1,4加成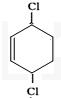
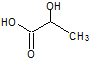 乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$
乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$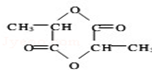 +2H2O
+2H2O .
.