题目内容
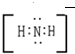
5.${\;}_{16}^{34}$S微粒中的质量子数是34,中子数18,是核外电子数是16(1)它与Na+形成的化合物的电子式
 ,
,(2)它与氢元素形成的共价化合物的电子式
 ,稳定性较好.
,稳定性较好.
分析 由于在原子的表达式中,左上角为质量数,左下角为质子数,据此求出${\;}_{16}^{34}$S微粒中的各种微粒的数目和微粒的种类;
(1)S和Na+形成的化合物为离子化合物,据此写出电子式;
(2)S元素和H元素形成的化合物为H2S,为共价化合物,根据硫元素的非金属性的强弱来分析其稳定性.
解答 解:由于在原子的表达式中,左上角为质量数,故${\;}_{16}^{34}$S微粒中的质量数为34,左下角为质子数,故质子数为16,此原子为S原子,而中子数=质量数-质子数=34-16=18,由于是原子,故电子数=质子数=16,故答案为:34;18;16;
(1)S和Na+形成的化合物为Na2S,是离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ,故答案为:
,故答案为: ;
;
(2)S元素和H元素形成的化合物为H2S,H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,由于硫元素的非金属性比较强,故H2S的热稳定性较好,故答案为:
,由于硫元素的非金属性比较强,故H2S的热稳定性较好,故答案为: ;较好.
;较好.
点评 本题考查学生电子式的书写知识和构成原子的微粒之间的数值关系,题目难度不大,结合物质的成键情况并根据电子式的书写规则解答.

练习册系列答案
相关题目
15.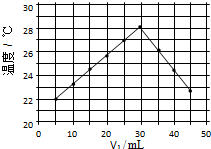 将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
 将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为1.5mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
16.某有机物的结构简式为 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )
①加成 ②水解 ③酯化 ④氧化 ⑤消去.
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成 ②水解 ③酯化 ④氧化 ⑤消去.
| A. | ①③④ | B. | ①③④⑤ | C. | ②③④ | D. | ①③⑤ |
13.表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素的符号:①N,⑥Si,⑦S.
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,称为两性的氢氧化物的是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(5)在③与④中,化学性质较活泼的是Na,请设计化学实验加以证明:用钠、镁跟水反应的实验证明:钠可以跟冷水剧烈反应,放出氢气,并生成强碱NaOH,镁跟沸水才反应,放出氢气,并生成中强碱Mg(OH)2.在⑧与⑫中,化学性质较活泼的是Cl,请设计化学实验加以证明:用氯气或氯水与溴化钠溶液反应的实验证明:溶液变为橙色,发生的反应为Cl2+2NaBr═2NaCl+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,称为两性的氢氧化物的是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(5)在③与④中,化学性质较活泼的是Na,请设计化学实验加以证明:用钠、镁跟水反应的实验证明:钠可以跟冷水剧烈反应,放出氢气,并生成强碱NaOH,镁跟沸水才反应,放出氢气,并生成中强碱Mg(OH)2.在⑧与⑫中,化学性质较活泼的是Cl,请设计化学实验加以证明:用氯气或氯水与溴化钠溶液反应的实验证明:溶液变为橙色,发生的反应为Cl2+2NaBr═2NaCl+Br2.
20.某化合物由A,B 2种元素组成,已知A,B两元素的质量比为7:4,相对原子质量之比为7:8,则此化合物分子式可能是( )
| A. | A2B | B. | AB | C. | AB2 | D. | A2B4 |
10.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>d | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 离子的氧化性:X+<W3+ | D. | 原子半径:X<W |
 、
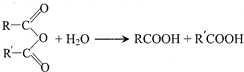
、 .
.
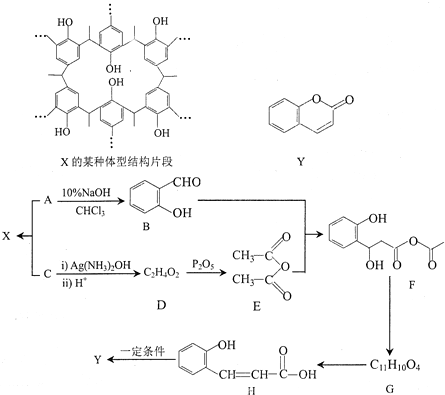
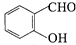 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基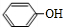 ,DCH3COOH,G
,DCH3COOH,G

 )氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式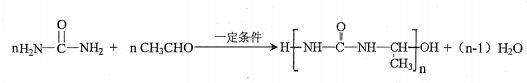
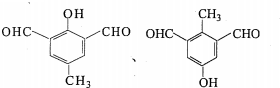 .
.