题目内容
9.下列化学用语表示正确的是( )| A. | Mg2+的结构示意图: | |
| B. | 乙酸的化学式:CH3CH2OH | |
| C. | 硫酸钾的电离方程式:K2SO4═${K}_{2}^{+}$+${SO}_{4}^{2-}$ | |
| D. | N2的结构式:N≡N |
分析 A.镁离子的核外电子总数为10,最外层满足8电子稳定结构;
B.乙酸的官能团为羧基,不是羟基;
C.硫酸钾电离出2个钾离子和1个硫酸根离子;
D.用短线代替所有的共用电子对即为结构式.
解答 解:A. 为镁原子结构示意图,Mg2+的质子数为12,电子数为10,离子结构示意图为:
为镁原子结构示意图,Mg2+的质子数为12,电子数为10,离子结构示意图为: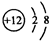 ,故A错误;
,故A错误;
B.乙酸为含有2个碳原子饱和一元羧酸,其结构简式为CH3COOH,故B错误;
C.硫酸钾电离出钾离子和硫酸根离子,电离方程式:K2SO4═2K++SO42-,故C错误;
D.氮气分子中含有氮氮三键,其结构式为N≡N,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及离子结构示意图、结构简式、电离方程式、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
19.下列结论错误的是 ( )
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | 只有① | B. | ①③⑤ | C. | ②④⑤⑥⑦ | D. | ②④⑥ |
20.某化合物由A,B 2种元素组成,已知A,B两元素的质量比为7:4,相对原子质量之比为7:8,则此化合物分子式可能是( )
| A. | A2B | B. | AB | C. | AB2 | D. | A2B4 |
4.有关苯的结构和性质,下列说法正确的是( )
| A. |  与 与 是同分异构体 是同分异构体 | |
| B. |  此反应是取代反应 此反应是取代反应 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
18.已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)+2H2O(l);△H=-484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ•mol-1 |
2. 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
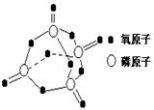
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如右图所示,则上表中X为( )
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
 、
、 .
. 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: