题目内容
8.现有一份含有FeCl3和FeCl2固体混合物,为测定各成分的含量进行如下两个实验:实验1
①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体17.22g.
实验2
①称取与实验1中相同质量的样品,将样品溶解;
②向溶解后的溶液中通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g.
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有烧杯、玻璃棒.
(2实验室保存FeCl2溶液时通常会向其中加入少量试剂铁粉和稀盐酸.
(3)实验2通入足量Cl2的目的是完全氧化FeCl2;涉及的化学反应的离子方程式是Cl2+2Fe2+=2Fe3++2Cl-.
(4)检述实验2的步骤④中沉淀已经洗涤干净的方法是取少量最后一次的洗涤液于试管中,向试管中溶液加适量AgNO3溶液,如未出现白色沉淀说明已洗净.
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)铁离子在溶液中存在水解平衡,生成氢氧化铁和盐酸,加热促进水解,Fe3++3H2O?Fe(OH)3+3H+,生成的盐酸易挥发,从而最终得到氢氧化铁固体,灼烧生成氧化铁,2Fe(OH)3$\frac{\underline{\;加热\;}}{\;}$Fe2O3+3H2O.
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及胶体的特性.以下关于胶体的说法不正确的是CE.
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.向Fe(OH)3胶体可以产生丁达尔效应,CuSO4溶液、水等分散系不能产生丁达尔效应
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算固体样品中FeCl3和FeCl2的物质的量之比为2:3.
分析 (1)固体溶解需要在烧杯中进行,同时要用玻璃棒搅拌;
(2)根据FeCl2易被空气中的氧气氧化成FeCl3,向溶液中加入少量铁粉,使被氧气氧化产生的FeCl3重新转化为FeCl2;另外FeCl2易水解,需要加入少量稀盐酸抑制其水解;
(3)实验2中通入足量的Cl2可将FeCl2氧化生成FeCl3;发生的反应为Cl2+2FeCl2=2FeCl3,可将其改写为离子方程式;
(4)检述实验2的步骤④中沉淀洗涤时,洗涤液中有Cl-,只有检验最后一次洗涤液中无Cl-,即可证明已经洗涤;
(5)铁离子易水解,且生成氢氧化铁和挥发性的稀盐酸,加热能促进水解,HCl挥发,得到氢氧化铁沉淀,氢氧化铁再受热分解,最后残留物为Fe2O3;
(6)根据胶体的本质特征及胶体能发生丁达尔效应、聚沉现象、电泳现象等性质判断;
(7)实验1得到的白色固体为AgCl,可计算出17.22gAgCl的物质的量;实验2最终的得固体为,可计算出4g氧化铁的物质的量,设FeCl3和FeCl2的物质的量分别为amol,bmol,根据原子守恒,建立方程式组来求解.
解答 解:(1)溶解所用到的仪器为烧杯、玻璃棒;故答案为:烧杯、玻璃棒;
(2)防止FeCl2溶液里的Fe2+被氧化及其水解,需要加入少量铁粉和稀盐酸,故答案为:铁粉、稀盐酸;
(3)Cl2将FeCl2氧化生成FeCl3,发生反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,故答案为:完全氧化FeCl2;Cl2+2Fe2+=2Fe3++2Cl-;
(4)取步骤④中沉淀洗涤时的最后-次洗涤液,先滴加稀硝酸酸化,再滴加AgNO3溶液,无白色沉淀,即可说明沉淀洗涤干净,故答案为:取少量最后一次的洗涤液于试管中,向试管中溶液加适量AgNO3溶液,如未出现白色沉淀说明已洗净;
(5)铁离子水解生成氢氧化铁和氢离子,水解离子反应为Fe3++3H2O?Fe(OH)3+3H+,加热促进水解,生成的HCl挥发,得到氢氧化铁沉淀,氢氧化铁再受热分解,发生2Fe(OH)3$\frac{\underline{\;加热\;}}{\;}$Fe2O3+3H2O,最后残留物为Fe2O3,故答案为:铁离子在溶液中存在水解平衡,生成氢氧化铁和盐酸,加热促进水解,Fe3++3H2O?Fe(OH)3+3H+,生成的盐酸易挥发,从而最终得到氢氧化铁固体,灼烧生成氧化铁,2Fe(OH)3$\frac{\underline{\;加热\;}}{\;}$Fe2O3+3H2O;
(6)A.胶体粒子介于溶液中的离子或分子与浊液中分散质之间,不能能透过滤纸,但不能透过半透膜,故A正确;
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,使得胶粒带电,在电场作用下发生定向移动,即电泳现象,故B正确;
C.Fe(OH)3胶体可产生丁达尔效应,而CuSO4溶液不能产生丁达尔效应,水是纯净物不是分散系,故C错误;
D.向Fe(OH)3胶体中滴加硫酸,会发生聚沉现象,有红褐色沉淀生成,过量的稀硫酸可以溶解氢氧化铁沉淀,随后沉淀消失,故D正确;
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质变性,故E错误;
答案为:CE;
(7)实验1得到17.22gAgCl;实验2最终4g氧化铁,设FeCl3和FeCl2的物质的量分别为amol,bmol,根据原子守恒,则有3amol+2bmol=$\frac{17.22g}{143.5g/mol}$=0.12mol(氯守恒)、amol+bmol=$\frac{4g}{160g/mol}$×2=0.05mol(铁守恒);解得:a=0.02,b=0.03;固体样品中FeCl3和FeCl2的物质的量之比为0.02mol:0.03mol=2:3,故答案为:2:3.
点评 本题主要考查了化学实验以及化学计算,涉及混合物的分离操作、盐类的水解、氧化还原反应及原子守恒的应用等,难度中等,对学生基础要求较高.

 小学教材全测系列答案
小学教材全测系列答案| A. | 使用滤纸称量氢氧化钠固体 | B. | 溶解后未冷却直接定容 | ||
| C. | 容量瓶不干燥,存有少量蒸馏水 | D. | 胶头滴管加水定容时俯视刻度 |
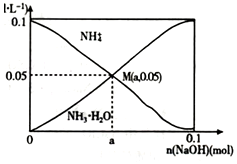 常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.lmol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H20的变化趋势如图 所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在 M 点时,n(OH- )-n(H+)=(a-0.05)mol | |
| C. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c( NH4+)>c(OH-)>c(H+) | |
| D. | 随着NaOH的加入,一定存在c(Cl-)+c(0H-)+c(NH3•H20)>0.lmol•L-1 |
| A. | c( NH4+)相等的NH4Cl溶液和(NH4)2Fe( SO4)2溶液中:c(Cl-)>c( SO42-) | |
| B. | 常温下,将pH=5的H2S04溶液加水稀释1000倍,所得溶液的pH=8 | |
| C. | 0.2 mol/LCH3COOH溶液与0.1 mol/LNaOH溶液等体积混合所得的溶液中:c( CH3COOH)+c( CH3COO -)=2c(Na+)=0.2 mol/L | |
| D. | 用甲基橙作指示剂,用标准盐酸滴定未知浓度的氨水,至终点时,溶液中:c(NH4+)=c(Cl-) |
| A. | 1.6gCH4中含有的分子数 | |
| B. | 1molH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下22.4LCO气体中含有的分子数 |
| A. | 溶解度(s ) | B. | 物质的量浓度(c ) | C. | 质量分数(w%) | D. | 摩尔质量(M ) |
| A. | 溴乙烷不溶于水,能溶于大多数有机溶剂 | |
| B. | 溴乙烷与NaOH的醇溶液共热可生成乙醇 | |
| C. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
| A. | 分子内共价键 | B. | 分子间的作用力 | ||
| C. | 分子间的距离 | D. | 分子内共价键的键长 |