题目内容
3.下列叙述正确的是( )| A. | 阳离子一定是金属离子,阴离子一定只含非金属元素 | |
| B. | 金属阳离子一定只具有氧化性,没有还原性 | |
| C. | 阴、阳离子相互作用后不一定形成离子化合物 | |
| D. | 金属和非金属化合一定生成离子化合物 |
分析 A.阳离子中可能为非金属元素,阴离子中可能含金属元素;
B.处于中间价元素的微粒具有氧化性、还原性,金属阳离子可具有还原性;
C.阴、阳离子相互作用后不一定形成离子化合物,可能是共价化合物;
D.金属和非金属化合可能为共价化合物.
解答 解:A.H+、NH4+不是金属离子,MnO4-中含有金属元素,故A错误;
B.Fe2+具有氧化性和还原性,故B错误;
C.H+与OH-作用生成水,水不是离子化合物,故C正确;
D.AlCl3为共价化合物,故D错误;
故选C.
点评 本题考查氧化还原反应及化合物类型,为高频考点,把握物质组成、性质、化学键为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
13.小明体检的血液化验单中,葡萄糖为 5.9mmol/L.表示该体检指标的物理量是( )
| A. | 溶解度(s ) | B. | 物质的量浓度(c ) | C. | 质量分数(w%) | D. | 摩尔质量(M ) |
11.可逆反应①X(g)+2Y(g)?2Z(g)、②2M(g)?N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:
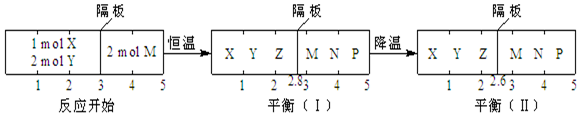
下列判断正确的是( )

下列判断正确的是( )
| A. | 反应①的正反应是吸热反应 | |
| B. | 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15 | |
| C. | 达平衡(I)时,X的转化率为$\frac{5}{11}$ | |
| D. | 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变 |
8.酸雨的水溶液的pH值范围是( )
| A. | pH小于7 | B. | pH小于5.6 | C. | pH大于5.6 | D. | pH小于0 |
15.在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)?2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
| t∕min | 2 | 4 | 7 | 9 |
| n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前4min的平均反应速率υ(Z)=0.0125 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大 |
12.常温下,NaHCO3溶液呈弱碱性.下列关于0.10mol•L-1NaHCO3溶液的说法正确的是( )
| A. | 加水稀释,HCO3-?H++CO32-平衡右移,溶液中氢离子浓度减小 | |
| B. | 加水稀释后,碳酸氢根离子水解平衡向右移动,溶液中氢氧根离子浓度减小 | |
| C. | 加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| D. | 温度升高,c(HCO3-)增大 |
16.下列有关叙述正确的是( )
| A. | BaCO3难溶于水中,可用作X射线透视肠胃的内服药 | |
| B. | 中国在建的第二艘航母中使用的碳纤维是一种新型的有机高分子材料 | |
| C. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 | |
| D. | 获得2015年诺贝尔医学奖的屠呦呦用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 |
 SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:
SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法: