题目内容
10.青蒿素和双氢青蒿素的结构简式如图所示,下列说法正确的是( )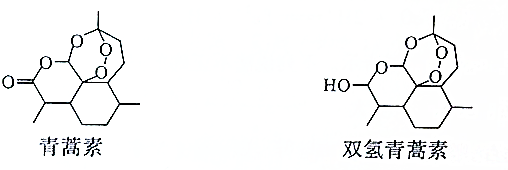
| A. | 双氢青篙素属于脂类物质 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素环上的一氯取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
分析 A.双氢青蒿素中含有醇羟基、醚键,不含酯基;
B.根据青蒿素结构简式确定分子式;
C.青蒿素环上氢原子种类是12;
D.青蒿素能和氢气发生加成反应生成双氢青蒿素.
解答 解:A.双氢青蒿素中含有醇羟基、醚键,不含酯基,所以双氢青蒿素不属于酯类物质,故A错误;
B.青蒿素的化学式为C15H22O5,故B错误;
C.青蒿素环上氢原子种类是12,所以其环上一氯取代物有12种,故C错误;
D.青蒿素中碳氧双键和氢气发生加成反应生成醇羟基,该反应属于加成反应,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查反应类型判断、取代物种类判断、反应类型判断等知识点,易错选项是C.

练习册系列答案
相关题目
20. 常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
 常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )| A. | 点o溶液、点b溶液、点d溶液的pH都大于7 | |
| B. | 点b溶液中:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) | |
| C. | 点o溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) | |
| D. | 点a溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
1.水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、SO42-中的若干种离子,某同学对该溶液进行了如下的实验:
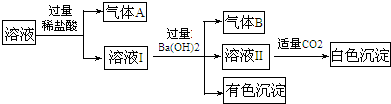
下列判断正确的是( )

下列判断正确的是( )
| A. | 气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NH4+、NO3- | |
| D. | 溶液中一定不存在大量的Na+ |
5.将NO2、O2、NH3的混合气体26.88L通过H2SO4后,溶液质量增加45.75g,气体体积缩小为2.24L,将带火星的木条插入剩余气体中,木条不复燃.则原混合气体的平均相对分子质量为(气体体积均在标准状况下测定)( )
| A. | 40.625 | B. | 42.15 | C. | 38.225 | D. | 42.625 |
15.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯含有的分子数为0.5NA | |
| B. | 3.2gCH4含有的化学键数为0.4NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 25℃时,1.0LpH=13的Ba(0H)2溶液中含有的0H-数为0.2NA |
5.用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答:
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-1)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-1)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-1)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-1)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93.0%(保留整数)
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是BCD(填答案字母序号)
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁.
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-1)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-1)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-1)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-1)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93.0%(保留整数)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁.
2.下列各表述与示意图一致的是( )
| A. | 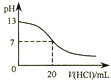 图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 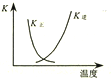 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 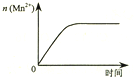 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 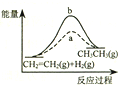 图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
3.下列比较顺序正确的是( )
| A. | 热稳定性:H2O>HF>H2S | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 原子半径:Na>Mg>O | D. | 氧化性:N2>Br2>Cl2 |