题目内容
20. 常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )| A. | 点o溶液、点b溶液、点d溶液的pH都大于7 | |
| B. | 点b溶液中:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) | |
| C. | 点o溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) | |
| D. | 点a溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |
分析 A.碳酸钠与盐酸恰好完全反应生成氯化钠、二氧化碳和水,溶液显酸性;
B.根据电荷守恒分析;
C.碳酸钠溶液中碳酸根离子发生两步水解,以第一步为主;
D.点a溶液中溶质等物质的量的碳酸钠、碳酸氢钠和氯化钠.
解答 解:A.碳酸钠与盐酸恰好完全反应生成氯化钠、二氧化碳和水,二氧化碳溶于水生成碳酸,所以溶液显酸性,即d点pH小于7,故A错误;
B.点b溶液中溶液中碳酸氢钠和氯化钠,溶液中电荷守恒为c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-),故B错误;
C.碳酸钠溶液中碳酸根离子发生两步水解,以第一步为主,第一步水解生成碳酸氢根离子和氢氧根离子,第二步水解生成碳酸和氢氧根离子,所以溶液中c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),故C正确;
D.点a溶液中溶质等物质的量的碳酸钠、碳酸氢钠和氯化钠,CO32-)根离子水解程度大于HCO3-,所以c(HCO3-)>c(CO32-),则c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+),故D错误.
故选C.
点评 本题考查了盐的水解原理的应用、元素化合物的性质、图象数据的处理知识等,题目难度中等,侧重于学生的分析能力和计算能力的考查.

练习册系列答案
相关题目
10.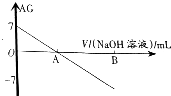 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-5 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(H+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(CH3COOH) |
11.“创新”化学小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究,取20.0mL样品溶液,向其中逐滴滴入0.10mol•L-1的稀盐酸,边滴边振荡,滴入盐酸的体积和产生的现象见下表.
请回答下列问题:
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 质量都为4.4g的CH3CHO和CO2含有的分子数均为0.1NA | |
| B. | 1molNa2O2中的离子总数为4NA | |
| C. | 密闭容器中,2molSO2和足量的O2反应转移的电子数为4NA | |
| D. | 1mol苯分子中所含的碳碳双键数为3NA |
15.下列与化学技术应用有关的说法不正确的是( )
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 工业上电解熔融状态的Al2O3制备Al | |
| D. | 为预防碘缺乏病,在食盐中加入碘单质 |
5.依据如图判断,下列说法正确的是( )


| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
12.下列说法不正确的是( )
| A. | “NO2球”浸泡在冷水中,颜色变浅:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反应FeCl3+3KSCN?Fe(SCN)3+3KCl 达平衡后,加入少量KCl固体,平衡逆向移动 | |
| C. | 在两支盛有双氧水的试管中,一支加入FeCl3溶液,反应明显加快,而另一支中加入CuSO4溶液,反应加快但不明显,说明催化剂具有较强选择性 | |
| D. | 用MnO2做催化剂,催化双氧水的分解,是因为MnO2可降低该反应活化能,提高活化分子的百分数 |
9.下列说法不正确的是( )
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
10.青蒿素和双氢青蒿素的结构简式如图所示,下列说法正确的是( )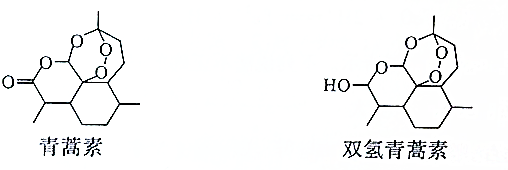
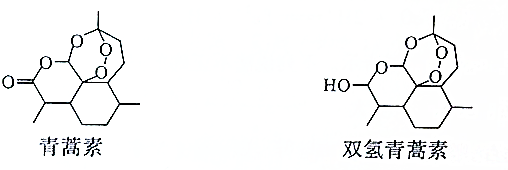
| A. | 双氢青篙素属于脂类物质 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素环上的一氯取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |