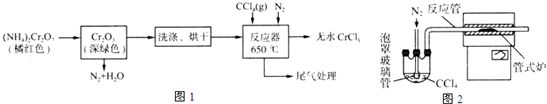
题目内容
1.水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、SO42-中的若干种离子,某同学对该溶液进行了如下的实验:
下列判断正确的是( )
| A. | 气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NH4+、NO3- | |
| D. | 溶液中一定不存在大量的Na+ |
分析 溶液加入盐酸生成气体,可能含有CO32-,或为Fe2+、NO3-发生氧化还原反应生成NO,溶液Ⅰ加入过量氢氧化钡生成气体B,一定为氨气,则存在NH4+,有色沉淀为氢氧化铁,则含有Fe2+,可知不存在CO32-,溶液Ⅱ呈碱性,与二氧化碳反应生成的白色沉淀碳酸钡,综上所述,一定存在Fe2+、NO3-、NH4+,以此解答该题.
解答 解:溶液加入盐酸生成气体,可能含有CO32-,或为Fe2+、NO3-发生氧化还原反应生成NO,溶液Ⅰ加入过量氢氧化钡生成气体B,一定为氨气,则存在NH4+,有色沉淀为氢氧化铁,则含有Fe2+,可知不存在CO32-,溶液Ⅱ呈碱性,与二氧化碳反应生成的白色沉淀碳酸钡,综上所述,一定存在Fe2+、NO3-、NH4+,
A.由上述分析可知,气体B一定是NH3,故A正确;
B.白色沉淀一定含碳酸钡,可能含氢氧化铝,故B错误;
C.由上述分析可知,溶液中一定存在Fe2+、NH4+、NO3-,Al3+不能确定,故C错误;
D.Na+不能确定是否含有,故D错误;
故选A.
点评 本题考查离子的推断,为高频考点,把握常见离子之间的反应、反应现象及白色沉淀与气体的判断是解本题关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.“创新”化学小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究,取20.0mL样品溶液,向其中逐滴滴入0.10mol•L-1的稀盐酸,边滴边振荡,滴入盐酸的体积和产生的现象见下表.
请回答下列问题:
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
12.下列说法不正确的是( )
| A. | “NO2球”浸泡在冷水中,颜色变浅:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反应FeCl3+3KSCN?Fe(SCN)3+3KCl 达平衡后,加入少量KCl固体,平衡逆向移动 | |
| C. | 在两支盛有双氧水的试管中,一支加入FeCl3溶液,反应明显加快,而另一支中加入CuSO4溶液,反应加快但不明显,说明催化剂具有较强选择性 | |
| D. | 用MnO2做催化剂,催化双氧水的分解,是因为MnO2可降低该反应活化能,提高活化分子的百分数 |
9.下列说法不正确的是( )
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
6.部分中学化学常见元素的原子结构和性质如下表所示:
请回答下列问题:(所有问题答案都要用元素符号或化学式表示)
(1)C、D、E的原子半径由大到小的顺序为Na>N>O,B、C、E的第一电离能由大到小的顺序为N>O>C.
(2)A、D、E中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键,写出其电子式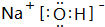 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲(C2A4),甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.已知:
①N2(s)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)在一容积固定的密闭容器中模拟工业制取NH3的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,并保持温度不变,已知初始加入1molN2和4molH2,且达到平衡后生成amolNH3,则达到平衡后,NH3在混合气体中的体积分数为$\frac{a}{5-a}$;若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与上次相同,在还应加入4molNH3.
| 元素代号 | 部分特征 |
| A | 单质为相同条件下密度最小的气体 |
| B | 基态原子最外层电子排布式为nsnnpn |
| C | 与元素E处于同一周期且电负性仅次于E |
| D | 位于第三周期且第一电离能最小 |
| E | 双原子分子单质在标准状况下密度为1.4285g/L |
| F | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
(1)C、D、E的原子半径由大到小的顺序为Na>N>O,B、C、E的第一电离能由大到小的顺序为N>O>C.
(2)A、D、E中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键,写出其电子式
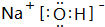 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲(C2A4),甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.已知:
①N2(s)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)在一容积固定的密闭容器中模拟工业制取NH3的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,并保持温度不变,已知初始加入1molN2和4molH2,且达到平衡后生成amolNH3,则达到平衡后,NH3在混合气体中的体积分数为$\frac{a}{5-a}$;若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与上次相同,在还应加入4molNH3.
13.研究发现,镭能蜕变为${\;}_{86}^{222}$Rn,故将${\;}_{86}^{222}$Rn称为镭射气.钍能衰变为${\;}_{86}^{220}$Rn,故将 ${\;}_{86}^{220}$Rn称为钍射气;锕能衰变为${\;}_{86}^{219}$Rn,故将${\;}_{86}^{219}$Rn称为锕射气.${\;}_{86}^{222}$Rn、${\;}_{86}^{220}$Rn、${\;}_{86}^{219}$Rn( )
| A. | 属于同种元素 | B. | 属于同位素 | C. | 属于同种核素 | D. | 属于同种原子 |
10.青蒿素和双氢青蒿素的结构简式如图所示,下列说法正确的是( )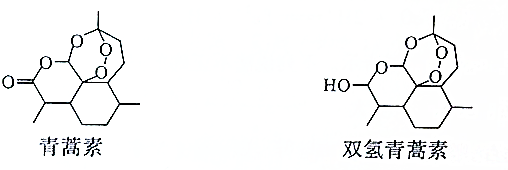
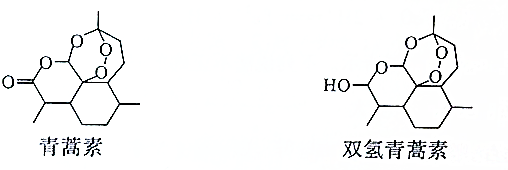
| A. | 双氢青篙素属于脂类物质 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素环上的一氯取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |