题目内容
8.甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.(1)以下是工业上合成甲醇的两个反应:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
上述反应符合“原子经济”原则的是I(填“I”或“II”).
(2)已知在常温常压下:
甲醇脱水反应2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9kJ•mol-1
甲醇制烯烃反应2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1kJ•mol-1
乙醇异构化反应C2H5OH(g)═CH3OCH3(g))?△H3=+50.7kJ•mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)═C2H5OH(g)的△H=-45.5kJ•mol-1.
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2?7)时,实验室利用下图装置模拟该法:

①N电极为燃料电池的正极,分别写出M、N两电极的电极反应式为CH3OH-6e-+H2O=6H++CO2↑、O2+4e?+4H+=2H2O.
②请完成电解池中Cr2O2?7转化为Cr3+的离子反应方程式:
1Cr2O2?7+6Fe2++14H+═2Cr3++6Fe3++7H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5mol•L-1 时,Cr3+沉淀完全,此时溶液的pH=5.6. (已知:Ksp=6.4×10?31,lg2=0.3)
分析 (1)“原子经济”是指在化学品合成过程中,所用的所有原材料尽可能多的转化到最终产物中,原子利用率为100%最经济;
(2)已知:①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9kJ•mol-1
②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1kJ•mol-1
③C2H5OH(g)═CH3OCH3(g))?△H3=+50.7kJ•mol-1
根据盖斯定律,①-②-③可得:C2H4 (g)+H2O(g)═C2H5OH(g),则△H=△H1-△H2-△H3;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,再结合电荷守恒、原子守恒配平方程式;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×10?31计算c(OH-),根据Kw=c(H+)×(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算.
解答 解:①反应I中所用原材料原子均转化到最终产物中,原子利用率为100%最经济,反应Ⅰ符合“原子经济”,故答案为:Ⅰ;
(2)已知:①2CH3OH(g)═CH3OCH3(g)+H2O(g)?△H1=-23.9kJ•mol-1
②2CH3OH(g)═C2H4 (g)+2H2O(g)?△H2=-29.1kJ•mol-1
③C2H5OH(g)═CH3OCH3(g))?△H3=+50.7kJ•mol-1
根据盖斯定律,①-②-③可得:C2H4 (g)+H2O(g)═C2H5OH(g),则△H=△H1-△H2-△H3=-23.9kJ•mol-1-(-29.1kJ•mol-1)-50.7kJ•mol-1=-45.5kJ•mol-1,
故答案为:-45.5;
(3)①氢离子由质子交换膜由M电极区移向N电极区,则M为负极、N为正极,负极上发生氧化反应,甲醇失去电子,生成二氧化碳与氢离子,负极电极反应式为:CH3OH-6e-+H2O=6H++CO2↑,正极发生还原反应,氧气获得电子,与通过质子交换膜的氢离子结合为水,正极电极反应式为:O2+4e?+4H+=2H2O,
故答案为:正;CH3OH-6e-+H2O=6H++CO2↑;O2+4e?+4H+=2H2O;
②电解池溶液里Cr2O72-转化为Cr3+,化合价降低共6价,左侧Fe电极为阳极,Fe失去电子生成Fe2+,酸性条件Fe2+将Cr2O72-还原为Cr3+,自身被氧化为Fe3+,化合价升高共1价,化合价升降最小公倍数为6,则Cr2O72-的系数为1,Fe2+的系数为6,反应离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:1;6;14H+;2;6;7;
(4)Ksp=c(Cr3+)×c3(OH-)=6.4×10?31,c(Cr3+)=1×10?5mol•L-1 时,溶液中c(OH-)=4×10?9mol•L-1,则c(H+)=$\frac{1{0}^{-14}}{4×1{0}^{-9}}$mol/L=2.5×10?6mol•L-1,则pH=-lg2.5×10?6=5.6,
故答案为:5.6.
点评 本题考查反应热计算、电解原理、氧化还原反应配平、溶度积有关计算等,(3)注意根据质子移动方向判断电极,是对学生综合能力的考查,难度中等.

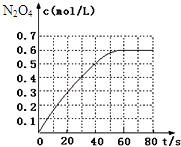 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小关系不确定 |
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
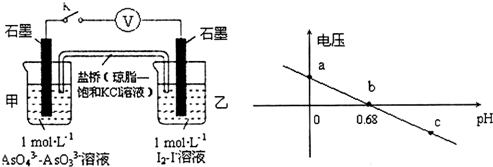
| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
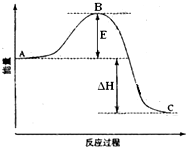 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: