题目内容
13.实验室需要400mL 0.5mol•L-1的稀硫酸溶液,现用密度为1.84g•mL-1,质量分数为98%浓硫酸来配制,请回答下列问题:(1)若要实施配制,下列仪器中,不会用到的是AC(填字母).
A.250mL容量瓶;B.500mL容量瓶;C.托盘天平;D.量筒; E.烧杯;F.玻璃棒
(2)配制过程中,除上述仪器外,尚缺的仪器是胶头滴管.
(3)未冷却至室温立即转移硫酸溶液,则所配硫酸溶液的浓度偏高(填“偏高”、“偏低”或“无影响”,下同);若定容时,滴加蒸馏水不慎超过了刻度线,则所配硫酸溶液的浓度偏低.
(4)通过计算,用量筒量取13.6mL浓硫酸.
分析 (1)(2)根据用浓溶液配制一定物质的量浓度溶液步骤选用仪器;
(3)分析不当操作对溶质的物质的量和溶液的体积,依据C=$\frac{n}{V}$进行误差分析;
(4)依据稀释前后溶质的物质的量不变计算需要的浓硫酸的体积.
解答 解:(1)用浓溶液配制一定物质的量浓度溶液步骤:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器:烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管;用不到的仪器:A.250mL容量瓶C.托盘天平;
故答案为:AC;
(2)依据(1)可知还缺少的仪器:胶头滴管;
故答案为:胶头滴管;
(3)未冷却至室温立即转移硫酸溶液,冷却后溶液体积偏小,溶液的物质的量浓度偏高;
若定容时,滴加蒸馏水不慎超过了刻度线,导致溶液体积偏大,溶液的物质的量浓度偏低;
故答案为:偏高;偏低;
(4)98%的浓硫酸(密度为1.84g•ml -3)的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积V,稀释前后溶质的物质的量不变,18.4mol/L×V=0.5mol•L-1×500mL,解得V=13.6mL;
故答案为:13.6.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度不大,注意掌握配制一定物质的量浓度的溶液步骤是解题关键,注意误差分析的方法和技巧.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
6.对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡状态时,4v正(O2)=5V逆(NO) | |
| B. | 化学反应速率的关系为2V正(NH3)=3V正(H2O) | |
| C. | 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到化学平衡状态 |
1.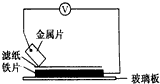 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
已知构成原电池两电极的金属活动性相差越大,电压表读数越大.请根据以上实验记录完成下列填空:
(1)金属C(填字母)可能是最强还原剂.
(2)若滤纸用稀硝酸溶液浸润,一段时间后在滤纸上能看到蓝色,则金属片为B(填字母),其对应的原电池正极的电极反应式为Cu-2e-=Cu2+.
(3)利用A和B两种金属相互置换反应可以设计出一种二次电池,其总反应可表示为:2B+AO$?_{②}^{①}$B2O+A
这个电池充电过程的反应为①(填①或②),得到这个结论的理由是金属性A>B,②为自发进行的氧化还原反应.
 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D| A.在四种金属中C的还原性最弱 |
| B.金属B能从硫酸铜溶液中置换出铜 |
| C.AD若形成原电池时A为正极 |
| D.AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
(1)金属C(填字母)可能是最强还原剂.
(2)若滤纸用稀硝酸溶液浸润,一段时间后在滤纸上能看到蓝色,则金属片为B(填字母),其对应的原电池正极的电极反应式为Cu-2e-=Cu2+.
(3)利用A和B两种金属相互置换反应可以设计出一种二次电池,其总反应可表示为:2B+AO$?_{②}^{①}$B2O+A
这个电池充电过程的反应为①(填①或②),得到这个结论的理由是金属性A>B,②为自发进行的氧化还原反应.
5.下列说法正确的是( )
| A. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 | |
| B. | SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 将浓氨水滴到氢氧化钠固体中可以制取氨气 | |
| D. | NaHCO3能与碱反应,因此食品工业上用作焙制糕点的膨松剂 |
2.在密闭容器中,一定量混合气体发生下列反应:aA(g)+bB(g)?cC(g)+dD(g),达到平衡后,测得C气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L.则下列叙述正确的是( )
| A. | 反应速率降低 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
20.CuSO4是一种重要的化工原料,有关制备及性质如下所示.下列说法错误的是( )

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示: