��Ŀ����
1��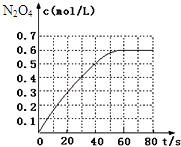 298Kʱ����2L�̶�������ܱ������У��������淴Ӧ��2NO2��g��?N2O4��g����H=-a kJ/mol ��a��0����N2O4�����ʵ���Ũ����ʱ��仯��ͼ����ƽ��ʱ��N2O4��Ũ��ΪNO2��2��������Ӧ��398K���У�ijʱ�̲��n��NO2��=0.6mol��n��N2O4��=1.2mol�����ʱ�����д�С��ϵ��ȷ���ǣ�������
298Kʱ����2L�̶�������ܱ������У��������淴Ӧ��2NO2��g��?N2O4��g����H=-a kJ/mol ��a��0����N2O4�����ʵ���Ũ����ʱ��仯��ͼ����ƽ��ʱ��N2O4��Ũ��ΪNO2��2��������Ӧ��398K���У�ijʱ�̲��n��NO2��=0.6mol��n��N2O4��=1.2mol�����ʱ�����д�С��ϵ��ȷ���ǣ�������| A�� | v��������v���棩 | B�� | v��������v���棩 | ||
| C�� | v������=v���棩 | D�� | v��������v���棩��С��ϵ��ȷ�� |
���� ��ͼ��֪N2O4��ƽ��Ũ��Ϊ0.6mol/L���ﵽƽ��ʱ��N2O4��Ũ��ΪNO2��2������NO2��ƽ��Ũ��Ϊ0.3mol/L������ƽ�ⳣ������ʽ����K��298K����2NO2��g��?N2O4��g����H=-a kJ/mol ��a��0������ӦΪ���ȷ�Ӧ�������¶ȣ�Kֵ��С�������֪��ʱ��Ũ����Q=K��298K����K��398K������Ӧ���淴Ӧ�����ƶ������V��������V���棩��
��� �⣺��ͼ��֪K��298K����N2O4��ƽ��Ũ��Ϊ0.6mol/L���ﵽƽ��ʱ��N2O4��Ũ��ΪNO2��2������NO2��ƽ��Ũ��Ϊ0.3mol/L����K=$\frac{c��{N}_{2}{O}_{4}��}{{c}^{2}��N{O}_{2}��}$=$\frac{0.6mol/L}{��0.3mol/L��^{2}}$=6.67L/mol��
��ӦΪ���ȷ�Ӧ�������¶ȣ�Kֵ��С���ܱ����������Ϊ2L������Ӧ��398K���У�ijʱ�̲��n��NO2��=0.6mol��n��N2O4��=1.2mol����˵�N2O4��Ũ��Ϊ0.6mol/L��NO2��Ũ��Ϊ0.3mol/L��Ũ����Q=$\frac{c��{N}_{2}{O}_{4}��}{{c}^{2}��N{O}_{2}��}$=$\frac{0.6mol/L}{��0.3mol/L��^{2}}$=6.67L/mol=K��298K����K��398K������Ӧ���淴Ӧ�����ƶ������V��������V���棩��
��ѡB��
���� ���⿼��֪ʶ��ȫ�棬�漰��ѧ��Ӧ���ʡ�ƽ�ⳣ���ļ��㡢ƽ����ƶ���ͼ�������֪ʶ�㣬���ջ����ǽ���ؼ����Ѷ��еȣ�

 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�| A�� | ��ⷨ����ͭʱ���Դ�ͭ����������ͭ������ | |
| B�� | Ǧ������Pb��������PbO2������ | |
| C�� | �����ʵ���Ũ����ȵ�NaCl��KBr�Ļ����Һ�еμ�AgNO3��Һ���Ȳ�������ɫ���� | |
| D�� | �����£�pH=3�����ᡢ����ֱ���ˮϡ��m����n����pH��ͬ����m��n |
| A�� | �ﵽ��ѧƽ��״̬ʱ��4v����O2��=5V����NO�� | |
| B�� | ��ѧ��Ӧ���ʵĹ�ϵΪ2V����NH3��=3V����H2O�� | |
| C�� | �ﵽ��ѧƽ��״̬ʱ�����������������������Ӧ���ʼ�С���淴Ӧ�������� | |
| D�� | ����λʱ��������xmolNO��ͬʱ������xmolNH3����Ӧ�ﵽ��ѧƽ��״̬ |
| A�� | �������϶���ʱ�������������۵����� | |
| B�� | ��ʯī�缫���������Һ����ʵ���ǵ��ˮ������ҺPHֵ���� | |
| C�� | ��ⷨ����ͭʱ�����һ��ʱ����Һ��C��Cu2+���������½� | |
| D�� | Ϊ��ֹ������µĸ����ܵ���ʴ���ɽ�����ֱ����Դ���������� |
 HCO3����H��
HCO3����H��