题目内容
3.苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面如图1是它的一种实验室合成路线: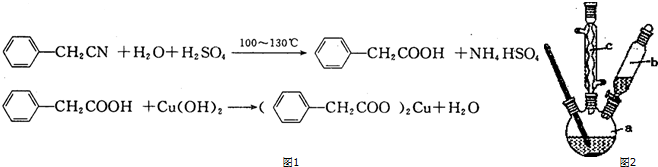
制备苯乙酸的装置示意图如图2(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇.
回答下列问题:
(1)在250mL三颈瓶a中加入70mL70%硫酸.配制此硫酸 时,加入蒸馏水与浓硫酸的先后顺序是先加水、再加入浓硫酸.
(2)将a中的溶液加热至100℃,通过仪器b缓缓滴加40g 苯乙腈到硫酸溶液中,然后升温至130℃继续反应.在实际操作时,发现b中液体不容易滴下来,请写出改进的办法改为恒压滴液漏斗或在滴加液体时打开上口活塞;仪器c的名称是球形冷凝管,其作用是冷凝回流(或使气化的反应液冷凝).
(3)反应结束后加适量冷水,再分离出苯乙酸粗品.加人冷水的目的是便于苯乙酸析出,下列仪器中可用于分离苯乙酸粗品的是(填标号)BCE.
A.分液 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)提纯粗苯乙酸操作的方法名称是重结晶,最终得到44g纯品,则苯乙酸的产率是94.6%(小数点后保留一位有效数字).
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应.
分析 (1)配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅;
(2)由图可知,c为冷凝管,使气化的液体冷凝回流,仪器b可加入反应液;
(3)反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度;分离苯乙酸粗品,利用过滤操作;
(4)苯乙酸微溶于冷水,在水中的溶解度较小;由反应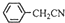 +H2O+H2SO4 $\stackrel{100-130℃}{→}$
+H2O+H2SO4 $\stackrel{100-130℃}{→}$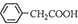 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度.
解答 解:(1)稀释浓硫酸放出大量的热,配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅,则加入蒸馏水与浓硫酸的先后顺序是先加水、再加入浓硫酸,
故答案为:先加水、再加入浓硫酸;
(2)在实际操作时,发现b中液体不容易滴下来,可以改为恒压滴液漏斗或在滴加液体时打开上口活塞,由图可知,c为球形冷凝管,其作用为回流(或使气化的反应液冷凝),仪器b的作用为滴加苯乙腈;滴加苯乙腈,
故答案为:改为恒压滴液漏斗或在滴加液体时打开上口活塞;球形冷凝管;冷凝回流(或使气化的反应液冷凝);
(3)反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;分离苯乙酸粗品,利用过滤操作,则需要的仪器为漏斗、烧杯、玻璃棒,
故答案为:便于苯乙酸析出;BCE;
(4)苯乙酸微溶于冷水,在水中的溶解度较小,则提纯苯乙酸的方法是重结晶;由反应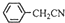 +H2O+H2SO4 $\stackrel{100-130℃}{→}$
+H2O+H2SO4 $\stackrel{100-130℃}{→}$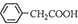 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44g}{46.5g}$×100%=94.6%,
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44g}{46.5g}$×100%=94.6%,
故答案为:重结晶;94.6;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度,然后与Cu(OH)2反应除去苯乙酸,即混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应,
故答案为:增大苯乙酸溶解度,便于充分反应.
点评 本题考查苯乙酸铜的合成,侧重物质制备实验及有机物性质的考查,把握合成反应及实验装置的作用为解答的关键,综合考查学生实验技能和分析解答问题的能力,题目难度中等,注意信息的处理及应用.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案蒸馏水中,所形成的分散系:①是溶液 ②是胶体 ③能产生丁达尔效应 ④分散质粒子能透过滤纸 ⑤分散质粒子不能透过滤纸 ⑥静置后,会析出黑色沉淀.
| A. | ①④⑥ | B. | ②③④ | C. | ②③⑤ | D. | ①⑤ |
①2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
②3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
③2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
④Mg+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2↑
⑤Mg3N2+6H2O═3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).
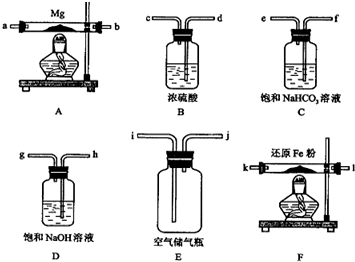
回答下列问题;
在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
| 装置 | 目的 |
(3)通气后,应先点燃F处的酒精灯,再点燃A处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?制得的氮化镁不纯;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁,若试纸不变蓝,则不含有Mg3N2.
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2
CH2═CH2+Br2→BrCH2═CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:
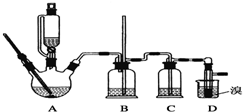
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母);
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母);
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 用物质A表示2 s内的平均反应速率为0.3 mol/(L•s) | |
| B. | 用物质B表示2s内的平均反应速率为0.6 mol/(L•s) | |
| C. | 2 s后物质B的浓度为0.35 mol/L | |
| D. | 2 s后物质A的转化率为30% |
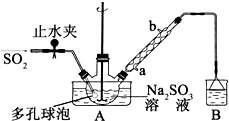 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解.在印染、医药以及原子能工业中有广泛应用.以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下: