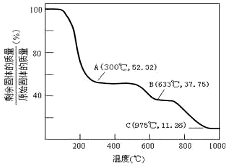
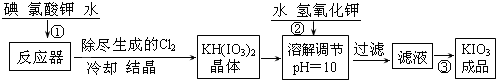
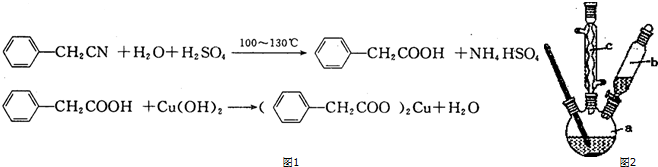
题目内容
18.在一密闭的2L容器中装有4mol SO2和2mol O2,在一定条件下开始反应.2min末测得容器中有1.6mol SO2,请计算:
(1)2min末SO3的浓度;
(2)2min内SO2的平均反应速率;
(3)2min内SO3的平均反应速率
(4)2min末SO2的转化率.
分析 2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
变化量(mol):2.4 1.2 2.4
2min末(mol):1.6 0.8 2.4
(1)根据c=$\frac{n}{V}$计算2min末SO3的浓度;
(2)根据v=$\frac{\frac{△n}{V}}{△t}$计算2min内SO2的平均反应速率v(SO2);
(3)二氧化硫与三氧化硫的化学计量数相等,则v(SO3)=v(SO2);
(4)SO2的转化率=$\frac{消耗量}{起始量}$×100%.
解答 解:2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):4 2 0
变化量(mol):2.4 1.2 2.4
2min末(mol):1.6 0.8 2.4
(1)2min末SO3的物质的量为2.4mol,则2min末SO3的浓度为:$\frac{2.4mol}{2L}$=1.2mol/L,
答:2min末SO3的浓度为1.2mol/L;
(2)2min内SO2的平均反应速率v(SO2)=$\frac{\frac{2.4mol}{2L}}{2min}$=0.6 mol/(L•min),
答:2min内SO2的平均反应速率为0.6 mol/(L•min);
(3)二氧化硫与三氧化硫的化学计量数相等,则2min内SO3的平均反应速率v(SO3)=v(SO2)=0.6 mol/(L•min),
答:2min内SO3的平均反应速率为0.6 mol/(L•min);
(4)2min末SO2的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{2.4mol}{4mol}$×100%=60%,
答:2min末SO2的转化率为60%.
点评 本题考查化学平衡的计算,题目难度不大,涉及化学反应速率、物质的量浓度、转化率的计算,明确三段式在化学平衡计算中的应用方法为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案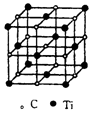 最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示.顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )| A. | TiC | B. | Ti6C7 | C. | Ti14C13 | D. | Ti13C14 |
| A. | 在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石);△H=+119kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与l mol NaOH溶液混合,放出的热量大于57.31 kJ |
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
 .
.