题目内容
4.把A克固体碳酸氢钠加热分解,冷却称重固体质量为B克,则:(1)当B=$\frac{53A}{84}$时,NaHCO3完全分解
(2)当B在0<B<$\frac{53A}{84}$范围时,NaHCO3部分分解,此时NaCO3为$\frac{84B-53A}{31}$g,Na2CO3为$\frac{52(A-B)}{31}$ g.
分析 (1)碳酸氢钠受热分解依据化学方程式定量关系计算分析,碳酸氢钠完全分解生成固体为碳酸钠;
(2)结合反应前后固体质量变化计算NaHCO3部分分解,此时NaHCO3和Na2CO3的质量.
解答 解:(1)把A克固体碳酸氢钠加热分解,冷却称重固体质量为B克,NaHCO3完全分解得到固体为碳酸钠,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
2×84 106
Ag Bg
B=$\frac{106A}{168}$=$\frac{53A}{84}$,
故答案为:$\frac{53A}{84}$.
(2)NaHCO3部分分解,反应前后固体质量变化分析,B的取值范围为:0<B<$\frac{53A}{84}$,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84 106 62
$\frac{168(A-B)}{62}$ g $\frac{106(A-B)}{62}$ g ( A-B)g
此时NaHCO3质量=Ag-$\frac{168(A-B)}{62}$g=$\frac{84B-53A}{31}$g,Na2CO3质量=$\frac{106(A-B)}{62}$g=$\frac{52(A-B)}{31}$g
故答案为:$\frac{84B-53A}{31}$g;$\frac{52(A-B)}{31}$g.
点评 本题考查了化学方程式的计算,注意反应前后差量计算的应用,掌握基础是解题关键,题目难度不大.

【查阅资料】

| 密度(g•cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
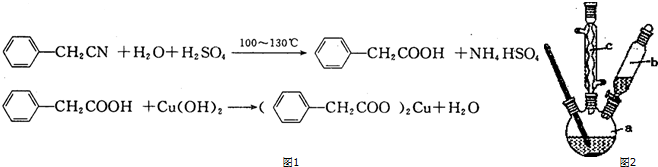
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.(图1)
(1)A中浓硫酸的作用是催化剂、脱水剂,将试管A置于水浴中的目的是冷却,防止环己烯挥发.
【精制粗产品】
(2)环己烯粗品中含有环己醇和少量酸性杂质等.加入c(填编号)洗涤,振荡、静置、分液,得到环己烯.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
(3)将环己烯用图2装置进行蒸馏,该装置中还缺少的玻璃仪器是温度计,加热蒸馏前要先加入生石灰的目的是除去水.
(4)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
| A. | 用氯化钠溶液做导电实验,灯泡发光:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- | |
| B. | 氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| A. | 在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)=C(金刚石);△H=+119kJ•mol-1”可知,金刚石比石墨稳定 | |
| C. | 在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=+285.8 kJ•mol-1 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3l kJ•mol-1,若将含0.5mol H2SO4的浓硫酸与l mol NaOH溶液混合,放出的热量大于57.31 kJ |

 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
 .
.