题目内容
4.工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图1,其中钛铁矿与浓硫酸发生反应的化学方程式为: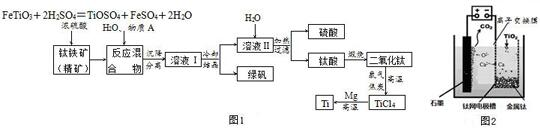
回答下列问题:
(1)钛铁矿和浓硫酸反应属于非氧化还原反应 (选填“氧化还原反应”或“非氧化还原反应”).
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是Fe,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是绿矾、硫酸.
离子交换膜
(3)反应TiCl4+2Mg═2MgCl2+Ti在Ar气氛中进行的理由是防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用.
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g)△H1═-72kJ•mol-1
TiO2(s)+2Cl2 (g)═TiCl4(g)+O2 (g)△H2═+38.8kJ•mol-1
C(s)+CO2(g)═2CO(g)?△H3═+282.8kJ•mol-1
反应C(s)+O2(g)═CO2 (g)的△H═-393.6 kJ/mol.
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图2所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.写出阳极所发生反应的电极反应式:2O2--4e-=O2↑或C+2O2--4e-=CO2↑,不需要(“需要”或“或不需要”)定期补充电解质.
分析 以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,钛铁矿石加入浓硫酸,钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O,加入水溶解后加入铁防止亚铁离子被氧化,沉降分离得到溶液Ⅰ,冷却结晶得到硫酸亚铁晶体,过滤得到溶液Ⅱ为TiOSO4,加热过滤得到滤液为硫酸,沉淀为钛酸,煅烧得到二氧化钛,加入氯气和焦炭高温反应,由二氧化钛制取四氯化钛,加入镁反应在Ar气氛中进行,发生的反应为;TiCl4+2Mg═2MgCl2+Ti.
(1)根据氧化还原反应中元素的化合价发生变化进行判断;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,根据流程确定所得到的副产物和可回收利用的物质;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和氮气二氧化碳都反应;
(4)已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
c、C(s)+CO2(g)=2CO(g)?△H3=+282.8kJ•mol-1,
利用盖斯定律将a-b-c可得反应C(s)+O2(g)=CO2 (g)的△H;
(5)依据装置图分析判断,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳;制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2$\frac{\underline{\;一定条件\;}}{\;}$Ti+2CaO,由此可见,CaO的量不变.
解答 解:以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,钛铁矿石加入浓硫酸,钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O,加入水溶解后加入铁防止亚铁离子被氧化,沉降分离得到溶液Ⅰ,冷却结晶得到硫酸亚铁晶体,过滤得到溶液Ⅱ为TiOSO4,加热过滤得到滤液为硫酸,沉淀为钛酸,煅烧得到二氧化钛,加入氯气和焦炭高温反应,由二氧化钛制取四氯化钛,加入镁反应在Ar气氛中进行,发生的反应为;TiCl4+2Mg═2MgCl2+Ti.
(1)钛酸亚铁的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,钛铁矿和浓硫酸反应后,TiOSO4中钛的化合价为+4价,硫为+6价,氧元素的化合价为-2价,FeSO4中铁元素的化合价为+2价,氧元素的化合价为-2价,无化合价的变化,是非氧化还原反应,
故答案为:非氧化还原反应;
(2)亚铁离子易被氧化为铁离子,加入金属铁可以防护被氧化,所以A是金属铁,根据流程,所得到的副产物是绿矾,可回收利用的物质是硫酸,
故答案为:Fe;绿矾;硫酸;
(3)Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,镁和二氧化碳反应生成氧化镁和碳,镁和氮气反应生成氮化镁,所以反应TiCl4+2Mg=2MgCl2+Ti需在Ar气氛中进行,
故答案为:防止高温下Mg和Ti与空气中的氧气(或氮气、二氧化碳)作用;
(4)已知反应a、TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H1=-72kJ•mol-1
b、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H2=+38.8kJ•mol-1
c、C(s)+CO2(g)=2CO(g)?△H3=+282.8kJ•mol-1
根据盖斯定律,反应C(s)+O2(g)=CO2(g)可以看成是a-b-c获得,所以该化学反应的焓变△H=-72kJ•mol-1-282.8kJ•mol-1-38.8kJ•mol-1=-393.6 kJ/mol,
故答案为:-393.6 kJ/mol;
(5)用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙金属发生还原反应,阳极图示产物可可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳,所以电极反应为:2O2--4e-=O2↑,或C+2O2--4e-=CO2↑,制备TiO2时,在电解槽发生如下反应:2CaO═2Ca+O2↑,2Ca+TiO2$\frac{\underline{\;一定条件\;}}{\;}$Ti+2CaO,由此可见,CaO的量不变,所以不需要定期补充电解质;
故答案为:2O2--4e-=O2↑或C+2O2--4e-=CO2↑,不需要.
点评 本题以流程题的形式综合考查元素化合物的性质知识,为高考常见题型,涉及物质性质的应用,离子性质的应用,分离操作的方法,电解池原理的应用,电极反应的书写原则等,要求学生具有分析和解决问题的能力,有利于培养学生的良好的科学素养,题目难度中等.

| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 同一弱电解质溶液,温度不同时,导电能力相同 |

| A. | 甲:NaOH; 乙:稀盐酸 | B. | 甲:水; 乙:氢氧化钠溶液 | ||
| C. | 甲:氢氧化钠溶液; 乙:水 | D. | 甲:稀盐酸; 乙:氯化钠溶液 |
①红色溶液很快褪色 ②红色溶液不褪色 ③有白色沉淀生成 ④溶液仍然透明.
| A. | 仅①和④ | B. | 仅①和③ | C. | 仅②和③ | D. | 仅②和④ |
| 编号 | Ⅰ | Ⅱ |
| 实验一 | 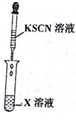  | 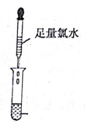 |
| 编号 | Ⅲ | |
| 实验二 |  | |
(2)实验步骤Ⅲ中反应的离子方程式为:Cl-+Ag+=AgCl↓;
(3)实验一证明X溶液中含Fe2+离子,实验Ⅱ证明X溶液中含Cl-离子.(填离子符号)
| A. | 加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | pH=13的溶液中:Na+、CO32-、K+、HCO3- | |
| C. | 在无色溶液中:Cu2+、Ca2+、SO42-、Cl- | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、Cl-、K+、SO42- |
| A. | 熔融的NaOH | B. | 硫磺 | C. | 石墨棒 | D. | KNO3晶体 |
| A. | 0.3mol•L-1 | B. | 0.4mol•L-1 | C. | 0.2mol•L-1 | D. | 0.6mol•L-1 |