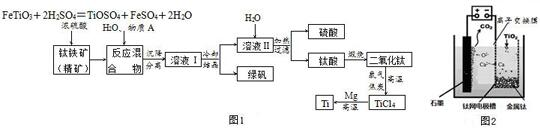
题目内容
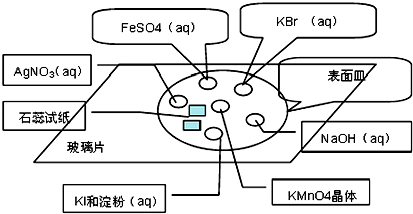
9.为了确认电解质溶液X的成分,某同学做了以下两组实验,请根据实验回答问题:| 编号 | Ⅰ | Ⅱ |
| 实验一 | 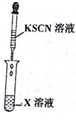  | 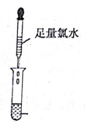 |
| 编号 | Ⅲ | |
| 实验二 |  | |
(2)实验步骤Ⅲ中反应的离子方程式为:Cl-+Ag+=AgCl↓;
(3)实验一证明X溶液中含Fe2+离子,实验Ⅱ证明X溶液中含Cl-离子.(填离子符号)
分析 (1)实验步骤Ⅰ中无明显现象说明溶液中无铁离子,实验步骤Ⅱ加入足量氯水后发现溶液变红色,说明溶液中的亚铁离子,由此分析书写离子方程式;
(2)加硝酸酸化的硝酸银有白色沉淀产生,说明溶液中有氯离子;
(3)实验一证明X溶液中一定含亚铁离子,实验Ⅱ证明X溶液中含氯离子.
解答 解:(1)实验步骤Ⅰ中无明显现象说明溶液中无铁离子,实验步骤Ⅱ加入足量氯水后发现溶液变红色,说明溶液中的亚铁离子,亚铁离子与氯气反应的方程式为:2Fe2++Cl2=2Fe3++2Cl-,溶液变红的离子方程式:Fe3++3SCN-=Fe(SCN)3,故答案为:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3;
(2)加硝酸酸化的硝酸银有白色沉淀产生,说明溶液中有氯离子,离子反应方程式为:Cl-+Ag+=AgCl↓,故答案为:Cl-+Ag+=AgCl↓;
(3)实验一证明X溶液中一定含亚铁离子,实验Ⅱ证明X溶液中含氯离子,故答案为:Fe2+; Cl-.
点评 本题考查了离子反应、常见的离子检验方法,题目难度中等,注意熟练掌握常见离子之间发生的反应现象及离子检验的方法,明确某些离子的特征反应,如氯离子、亚铁离子的特征反应.

练习册系列答案
相关题目
19.用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(H+)>c(OH-) | D. | c(NH4+)=c(Cl-),c(OH-)=c(H+) |
14.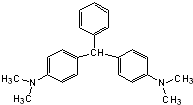 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )| A. | 分子中所有的碳原子可能在同一平面上 | |
| B. | 无色孔雀石绿与氢气完全加成后的产物的核磁共振氢谱中有7个峰 | |
| C. | 无色孔雀石绿可与溴水中的溴发生加成反应 | |
| D. | 在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应 |
1.下列有机知识正确的有( )个
①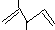 名称:2,3-二甲基-1,5-戊二烯 ②乙烯的实验式;CH2
名称:2,3-二甲基-1,5-戊二烯 ②乙烯的实验式;CH2
③用质谱仪和红外光谱均可以获得有机物所含化学键或官能团信息
④乙醇的分子式:C2H5OH
⑤苯乙炔共线的原子最多有6个
⑥对甲基苯甲醇的结构简式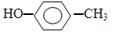
①
 名称:2,3-二甲基-1,5-戊二烯 ②乙烯的实验式;CH2
名称:2,3-二甲基-1,5-戊二烯 ②乙烯的实验式;CH2③用质谱仪和红外光谱均可以获得有机物所含化学键或官能团信息
④乙醇的分子式:C2H5OH
⑤苯乙炔共线的原子最多有6个
⑥对甲基苯甲醇的结构简式

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
18.能够证明溶液中一定大量存在CO32-的是( )
| A. | 加入硝酸银溶液时有白色沉淀产生 | |
| B. | 加入盐酸时有无色无味气体产生,该气体能使澄清石灰水变浑浊 | |
| C. | 加入氯化钙溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,且产生可使澄清石灰水变浑浊的无色无味气体 | |
| D. | 加入氢氧化钡溶液时有白色沉淀,再加稀盐酸反应现象如C |
19.下列氢键最强的是( )
| A. | S-H…O | B. | N-H…N | C. | F-H…F | D. | C-H…N |
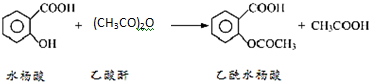
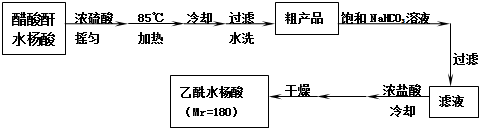
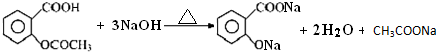
 阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(
阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(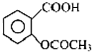 ).
).