题目内容
14.有9.7g Cu和Zn的合金与足量的稀硝酸反应,还原产物只有NO气体,其体积在标准状况下为2.24L.将溶液稀释为1L,测得溶液的c(H+)=0.1mol•L-1,此时溶液中NO3-的浓度为( )| A. | 0.3mol•L-1 | B. | 0.4mol•L-1 | C. | 0.2mol•L-1 | D. | 0.6mol•L-1 |
分析 n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子物质的量=0.1mol×(5-2)=0.3mol;Cu、Zn分别与稀硝酸反应中生成+2价金属阳离子,则每个金属原子生成金属阳离子时失去2个电子,根据金属和转移电子关系式得[n(Cu)+n(Zn)]=$\frac{1}{2}$n(e-)=$\frac{1}{2}$×0.3mol=0.15mol,溶液中根据电荷守恒得c(NO3-)=c(H+)+2[c(Cu2+)+c(Zn2+)],据此分析解答.
解答 解:n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子物质的量=0.1mol×(5-2)=0.3mol;Cu、Zn分别与稀硝酸反应中生成+2价金属阳离子,则每个金属原子生成金属阳离子时失去2个电子,根据金属和转移电子关系式得[n(Cu)+n(Zn)]=$\frac{1}{2}$n(e-)=$\frac{1}{2}$×0.3mol=0.15mol,溶液中根据电荷守恒得c(NO3-)=c(H+)+2[c(Cu2+)+c(Zn2+)],结合Cu、Zn原子守恒得c(NO3-)=c(H+)+2[c(Cu2+)+c(Zn2+)]=c(NO3-)=c(H+)+2[c(Cu)+c(Zn)]=0.1mol/L+2×$\frac{0.15mol}{1L}$=0.4mol/L,故选B.
点评 本题考查氧化还原反应方程式的有关计算,为高频考点,明确各个物理量关系是解本题关键,注意原子守恒、转移电子守恒的灵活运用,知道转移电子物质的量等于金属物质的量的关系,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列氢键最强的是( )
| A. | S-H…O | B. | N-H…N | C. | F-H…F | D. | C-H…N |
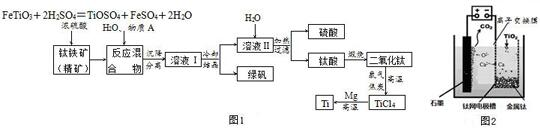
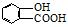 ⑤聚乙烯⑥
⑤聚乙烯⑥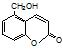 ,⑦丁子香酚
,⑦丁子香酚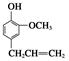
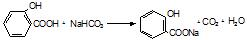 .
.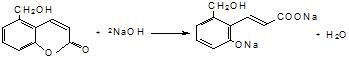 .
.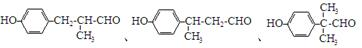 等.
等.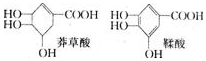
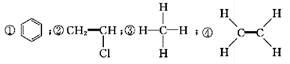
 反应是 ( )
反应是 ( )
 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0