题目内容
15.如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是( )
| A. | 甲:NaOH; 乙:稀盐酸 | B. | 甲:水; 乙:氢氧化钠溶液 | ||
| C. | 甲:氢氧化钠溶液; 乙:水 | D. | 甲:稀盐酸; 乙:氯化钠溶液 |
分析 NH4HCO3、NH4Cl、KCl加入试剂甲生成氨气,甲应为氢氧化钠溶液,碳酸氢铵可与酸反应生成气体,以此解答该题.
解答 解:甲物质能和碳酸氢铵、氯化铵反应生成有氨味的气体,说明甲物质显碱性,应为氢氧化钠,乙物质能和碳酸氢铵反应生成气体,同时不能和氯化铵反应,说明乙物质显酸性,题中盐酸符合,只有A正确.
故选A.
点评 本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质,为解答该题的关键,难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
5.已知将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 由上述原理可推知H2的燃烧热为241.9 kJ/mol | |
| C. | 反应②中的能量变化可用图表示: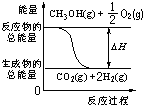 | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
6.反应A(g)+3B(g)?2C(g)△H<0,达平衡后,将反应体系的温度升高,下列叙述中正确的是( )
| A. | 逆反应速率增大更大,平衡向逆反应方向移动 | |
| B. | 正反应速率增大更大,平衡向正反应方向移动 | |
| C. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
3.下列说法中正确的是( )
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 伴有能量变化的变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
10.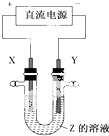 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 外加电流的阴极保护法中,Y是待保护金属 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
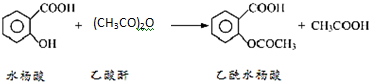
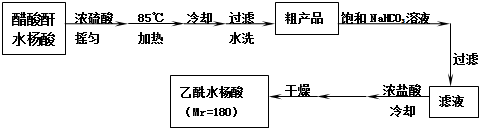
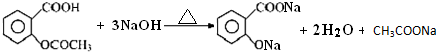
 阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(
阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(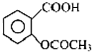 ).
).
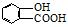 ⑤聚乙烯⑥
⑤聚乙烯⑥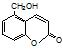 ,⑦丁子香酚
,⑦丁子香酚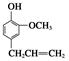
 .
.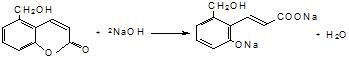 .
.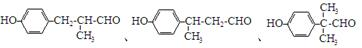 等.
等.