题目内容
14.下列有关叙述中正确的是( )| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 同一弱电解质溶液,温度不同时,导电能力相同 |
分析 A..强电解质完全电离;
B.电解质的水溶液的导电能力和电解质强弱无关,和离子浓度、所带电荷有关;
C.强电解质是在水溶液里完全电离的电解质;
D.弱电解质存在电离平衡,电离过程是吸热过程,温度改变,电离平衡移动,离子浓度不同.
解答 解:A.强电解质完全电离,不可逆,故A正确;
B.导电能力的强弱与参与导电的自由移动的离子的浓度大小有关,强电解质如果浓度很小,导电能力也可能比浓的弱电解质溶液的导电能力弱,故B错误;
C.电解质的强弱和溶解度无关,乙酸易溶于水,但它是弱酸,故C错误;
D.弱电解质存在电离平衡,电离过程是吸热过程,温度改变,电离平衡移动,离子浓度不同,导电能力不同,故D错误,故选A.
点评 本题考查强弱电解质的概念,难度不大,注意电解质的强弱和溶解度无关.

练习册系列答案
相关题目
4.设NA为阿佛加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| B. | 在标准状况下,22.4L Cl2完全溶于水转移的电子数目的为NA | |
| C. | 1L 0.1 mol•L-1 NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 常温下,pH=7的NaCl溶液中含有的OH-数目为10-7NA |
5.已知将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 由上述原理可推知H2的燃烧热为241.9 kJ/mol | |
| C. | 反应②中的能量变化可用图表示: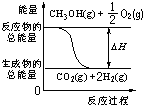 | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
19.用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(H+)>c(OH-) | D. | c(NH4+)=c(Cl-),c(OH-)=c(H+) |
6.反应A(g)+3B(g)?2C(g)△H<0,达平衡后,将反应体系的温度升高,下列叙述中正确的是( )
| A. | 逆反应速率增大更大,平衡向逆反应方向移动 | |
| B. | 正反应速率增大更大,平衡向正反应方向移动 | |
| C. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
3.下列说法中正确的是( )
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 伴有能量变化的变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
 .
. PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.