题目内容
20.下列说法不正确的是( )| A. | 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸 | |
| B. | 相同温度相同pH的CH3COONa、NaAlO2和NaHCO3三种溶液的物质的量浓度大小为:c(NaAlO2)<c(NaHCO3)<c(CH3COONa) | |
| C. | 0.1 mol/L的NaA溶液和0.1 mol/L的HA溶液等体积混合pH=4.75,则溶液:c (HA)+2c(H+)=2c(OH-)+c(A-) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
分析 A.将pH=4的某酸稀释10倍,测得其pH<5,说明酸没有完全电离;
B.溶液中氢氧根离子浓度相同,盐中阳离子相同,酸越弱,其盐的酸根水解程度越大;
C.根据电荷守恒可知:c(A-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可得:c(A-)+c(HA)=2c(Na+),
D.溶液pH=7,NaOH稍微过量,溶液中c(OH-)=c(H+);
解答 解:A.将pH=4的某酸稀释10倍,测得其pH<5,说明酸没有完全电离,应为弱酸,故A正确;
B.CH3COONa、NaAlO2和NaHCO3是盐,PH值相同,四种盐的阳离子相同,其阴离子对应的酸越弱,酸根的水解程度越大,酸性:醋酸>碳酸>碳酸氢根>偏铝酸,PH值相同,酸根的水解程度越大,其物质的量浓度越小,故浓度c(NaAlO2)<c(NaHCO3)<c(CH3COONa),故B正确;
C.0.1 mol/L的NaA溶液和0.1 mol/L的HA溶液等体积混合pH=4.75,溶液显酸性,根据电荷守恒可知:c(A-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可得:c(A-)+c(HA)=2c(Na+),二者结合得到:2c(H+)+c(HA)=c(A-)+2c(OH-),故C正确;
D.溶液pH=7,NaOH稍微过量,则c(Na+)>c(SO42-),溶液中c(OH-)=c(H+),所以溶液中离子浓度关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D错误;
故选D.
点评 本题考查离子浓度大小比较、弱电解质电离平衡、电解质溶液中微粒的关系、溶液酸碱性等,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握盐类水解和弱电解质的电离特点,结合物料守恒解答该题,题目难度中等.

 暑假作业海燕出版社系列答案
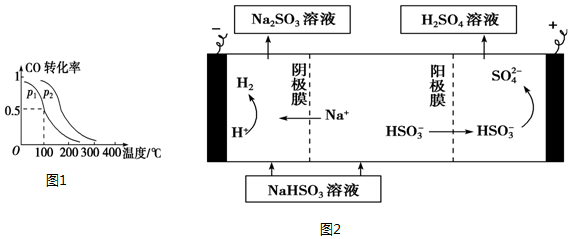
暑假作业海燕出版社系列答案| A. | 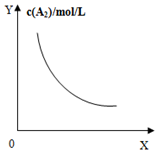 对于反应:A2(g)+3B2(g)?2AB2(g),图①中的横轴x可以表示压强 | |
| B. | 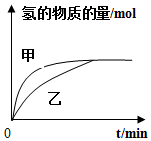 如图表示其他条件相同时,甲、乙两份等质量锌粉分别与足量稀硫酸反应,甲中加入少量铜粉 | |
| C. | 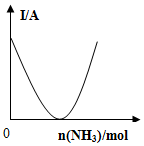 如图可表示乙酸溶液中通入氨气至过量时溶液导电性的变化 | |
| D. | 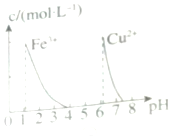 据图,若除去0.1mol•L-1CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
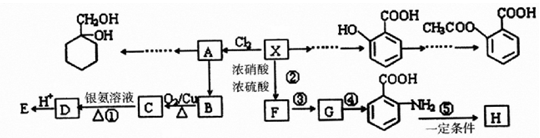
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH- | |
| B. | 电解时,电子流动路径是:负极-→外电路-→阴极-→溶液-→阳极-→正极 | |
| C. | 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 | |
| D. | 当电池中消耗0.02g H2时,a极周围会产生0.02gH2 |
| A. | 向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 | |
| B. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ | |
| C. | 在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性 | |
| D. | 向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质 |
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素有浓度、压强、温度和催化剂 | |
| C. | 可逆反应达到化学平衡时,正、逆反应的速率都不为0 | |
| D. | 增大反应物浓度、提高反应温度都能增大反应速率 |

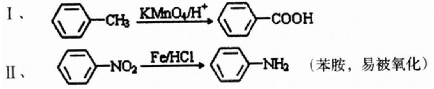
 ;
;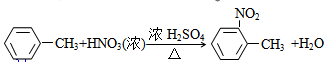 ;
;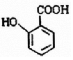 有多种同分异构体,写出符合下列条件的所有结构简式:
有多种同分异构体,写出符合下列条件的所有结构简式: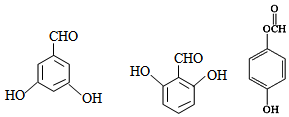 ;
;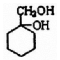 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)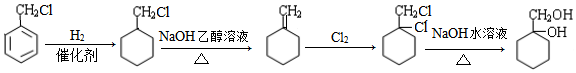 .
.