题目内容
10.下列离子组能大量共存且加入相应试剂后发生反应的离子方程式正确的是( )| 离子组 | 加入试剂 | 加入试剂后发生反应 | |
| A | K+、Fe2+、I- | 少量的酸性KMnO4溶液 | 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O |
| B | Fe3+、I-、SO42- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| D | Al3+、Cl-、NO3- | 过量浓氨水 | Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碘离子还原性大于亚铁离子,酸性高锰酸钾溶液少量时碘离子优先反应;
B.铁离子能够氧化碘离子,不能共存;
C.钡离子与生成的碳酸根离子生成碳酸钡沉淀;
D.三种离子之间不反应,加入氨水后生成氢氧化铝沉淀.
解答 解:A.还原性Fe2+<I-,加入少量的酸性KMnO4溶液后碘离子优先反应,正确的离子方程式为:10I-+2MnO4-+16H+═5I2+2Mn2++8H2O,故A错误;
B.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Ba2+、HCO3-与NaOH溶液反应生成碳酸钡沉淀,正确的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,故C错误;
D.Al3+、Cl-、NO3-之间不反应,能够共存,加入氨水后发生反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故D正确;
故选D.
点评 本题考查较为综合,涉及离子方程式书写、离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握离子方程式的书写原则,试题有利于提高学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.等物质的量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述不正确的是( )
| A. | 金属Al无剩余 | B. | 有白色沉淀生成 | ||
| C. | 所得气体全部为氢气 | D. | Na的物质的量是0.6mol |
1.短周期A、B、C、D、E五种主族元素,原子序数依次增大,B、C、E最外层电子数之和为11,A原子最外层电子数是次外层电子数的2倍,C是同周期中原子半径最大的元素,工业上一般通过电解氧化物的方法获得D的单质,E单质是制备太阳能电池的重要材料.下列说法正确的是( )
| A. | 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多 | |
| B. | C与D的最高价氧化物对应的水化物的碱性相比,后者更强 | |
| C. | 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高 | |
| D. | 简单离子半径:B<C |
18.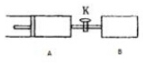 如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )
如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )
 如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )
如图所示,向A、B中均充入1mol x、1mol Y,起始过A、B的体积都等于1L.在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0,达平衡时,A的体积为1.4L.下列说法错误的是( )| A. | 两容器中的反应分别达到平衡时,反应物X的速率:v(B)>v(A) | |
| B. | A容器中x的转化率为80% | |
| C. | 平衡时的压强:PA<PB | |
| D. | 平衡时Y体积分数:A>B |
5.下列各项试验相应操作、实验现象及原因解释或推论合理的是( )
| 选项 | 操作 | 现象 | 解释或理论 |
| A | 把铁片投入浓硫酸 | 无明显变化 | 常温下铁不与浓硫酸反应 |
| B | 将浓硫酸滴到白纸上 | 白纸变黑 | 浓硫酸具有强氧化性,导致纸中的纤维素碳化 |
| C | 把二氧化硫通入溴水 | 溴水褪色 | 说明二氧化硫具有漂白性 |
| D | 用湿润的红色石蕊试纸检验某气体 | 试纸变蓝 | 该气体是氨气 |
| A. | A | B. | B | C. | C | D. | D |
15.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 1 LpH=l Ba(OH)2溶液中所含OH-的数目为0.2NA | |
| B. | 28g聚乙烯 中含有的碳原子数为2NA 中含有的碳原子数为2NA | |
| C. | 1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的数目为NA | |
| D. | 1 mol Na与O2完全反应生成Na2O和Na2O2的混合物,转移的电子总数为NA |
2.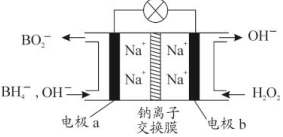 某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
 某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )| A. | 每消耗3mol H2O2,转移6mol e- | |
| B. | 电池工作时Na+从b极区移向a极区 | |
| C. | b极上的电极反应式为:H2O2+2e-═2OH- | |
| D. | a极上的电极反应式为:BH4-+8OH--8e-═BO2-+6H2O |
19.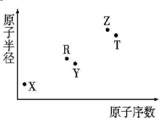 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )| A. | X和Y组成的化合物的水溶液保存在塑料瓶中 | |
| B. | 原子半径和离子半径均满足:Y<Z | |
| C. | 最高价氧化物对应的水化物酸性:Z>T | |
| D. | 含Z元素的盐溶液一定显酸性 |
20.下列有关说法正确的是( )
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | 将 0.1 mol•L-1NH4A1(SO4)2 溶液与 0.3 mol•L-1Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++40H-═AlO2-+2BaSO4↓+2H2O |