题目内容
有某种含有少量FeCl2杂质的FeCl3样品.现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2-3g范围内):
②向样品中加入l0mL 6moL?L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重.
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是 ;
(2)加入氯水后,反应的离子方程式为 ;
(3)加入过量氨水生成沉淀的离子方程式为 ;
(4)若不用氯水,可用下列试剂中的 代替(填序号).
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是 .
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为 (请把结果约到最简).
①准确称量mg样品(在2-3g范围内):
②向样品中加入l0mL 6moL?L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重.
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是
(2)加入氯水后,反应的离子方程式为
(3)加入过量氨水生成沉淀的离子方程式为
(4)若不用氯水,可用下列试剂中的
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)FeCl2、FeCl3都是强酸弱碱盐,亚铁离子、铁离子水解导致溶液变浑浊,为抑制水解加入稀盐酸;
(2)氯气具有强氧化性,能将亚铁离子氧化为铁离子;
(3)铁离子和一水合氨反应生成氢氧化铁红褐色沉淀;
(4)除去氯化铁中的氯化亚铁时不能引进新的杂质;
(5)判断沉淀是否洗净的方法是:取少量洗涤液加入少量硝酸银溶液,如果不产生沉淀就说明洗涤干净;
(6)将氢氧化铁灼烧得到Fe2O3,先计算氧化铁中铁元素质量,从而计算铁元素质量分数.
(2)氯气具有强氧化性,能将亚铁离子氧化为铁离子;
(3)铁离子和一水合氨反应生成氢氧化铁红褐色沉淀;
(4)除去氯化铁中的氯化亚铁时不能引进新的杂质;
(5)判断沉淀是否洗净的方法是:取少量洗涤液加入少量硝酸银溶液,如果不产生沉淀就说明洗涤干净;
(6)将氢氧化铁灼烧得到Fe2O3,先计算氧化铁中铁元素质量,从而计算铁元素质量分数.
解答:
解:(1)FeCl2、FeCl3都是强酸弱碱盐,亚铁离子、铁离子水解生成难溶性的氢氧化亚铁、氢氧化铁导致溶液变浑浊,为抑制水解加入稀盐酸,
故答案为:抑制Fe2+、Fe3+水解;
(2)氯气具有强氧化性,能将亚铁离子氧化为铁离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)铁离子和一水合氨反应生成氢氧化铁红褐色沉淀,离子方程式为Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+;
(4)除去氯化铁中的氯化亚铁时不能引进新的杂质,双氧水能氧化氯化亚铁且不阴极杂质,碘和铁离子反应生成亚铁离子,次氯酸钠和亚铁离子反应生成铁离子但引进新的杂质,故选A;
(5)判断沉淀是否洗净的方法是:取少量洗涤液加入少量硝酸银溶液,如果不产生沉淀就说明洗涤干净,否则说明洗涤不干净,故答案为:取少量洗涤液加入少量硝酸银溶液,如果不产生沉淀就说明洗涤干净;
(6)将氢氧化铁灼烧得到Fe2O3,氧化铁质量=(w2-w1)g×
×100%=0.7 (w2-w1)g,
样品中铁元素质量分数=
×100%=
%,
故答案为:
%.
故答案为:抑制Fe2+、Fe3+水解;
(2)氯气具有强氧化性,能将亚铁离子氧化为铁离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)铁离子和一水合氨反应生成氢氧化铁红褐色沉淀,离子方程式为Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3.H2O=Fe(OH)3↓+3NH4+;
(4)除去氯化铁中的氯化亚铁时不能引进新的杂质,双氧水能氧化氯化亚铁且不阴极杂质,碘和铁离子反应生成亚铁离子,次氯酸钠和亚铁离子反应生成铁离子但引进新的杂质,故选A;
(5)判断沉淀是否洗净的方法是:取少量洗涤液加入少量硝酸银溶液,如果不产生沉淀就说明洗涤干净,否则说明洗涤不干净,故答案为:取少量洗涤液加入少量硝酸银溶液,如果不产生沉淀就说明洗涤干净;
(6)将氢氧化铁灼烧得到Fe2O3,氧化铁质量=(w2-w1)g×
| 56×2 |
| 160 |
样品中铁元素质量分数=
| 0.7(w2-w1)g |
| mg |
| 70(w2-w1) |
| m |
故答案为:
| 70(w2-w1) |
| m |
点评:本题考查物质含量测定,侧重考查氧化还原反应、离子方程式的书写、计算、除杂等知识点,明确实验原理是解本题关键,注意除杂遵循的规则,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学式只能表示一种纯净物的是( )
| A、CF2Cl2 |
| B、C3H6 |
| C、C6H12O6 |
| D、C2H4O2 |
 取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢与R-H(s)进行如下反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),充分反应后,过滤(用锥形瓶盛装滤液),再用蒸馏水洗涤沉淀,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据,下列有关说法正确的是( )
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢与R-H(s)进行如下反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),充分反应后,过滤(用锥形瓶盛装滤液),再用蒸馏水洗涤沉淀,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据,下列有关说法正确的是( )| A、以酚酞为指示剂时,滴定至终点时溶液由红色变为无色 |
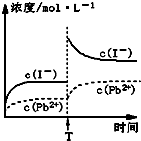
| B、在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小 |
| C、温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如右图所示 |
| D、本次实验测得的t℃PbI2的Ksp=4×10-9 |
在一密闭绝热容器中,发生放热反应:SO2(g)+NO2(g)?SO3(g)+NO(g),下列有关说法正确的是( )
| A、反应达到平衡时,降低温度,平衡逆向移动 |
| B、使用催化剂,正反应速率增大,逆反应速率减小 |
| C、若反应体系温度不再变化,说明反应达到平衡状态 |
| D、减小SO2的浓度,平衡正向移动 |
某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度.有关的叙述正确的是( )
| A、H2Y的电离方程式为:H2Y=2H++Y2- |
| B、在该酸式盐溶液中:[Na+]>[Y2-]>[HY-]>[OH-]>[H+] |
| C、HY-的水解方程式:HY-+H2O?H3O++Y2- |
| D、在该酸式盐溶液中:[Na+]>[HY-]>[OH-]>[H+]>[Y2-] |
 )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:

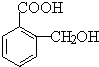 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
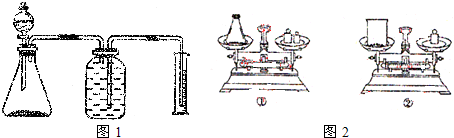
 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.